フェノールとは
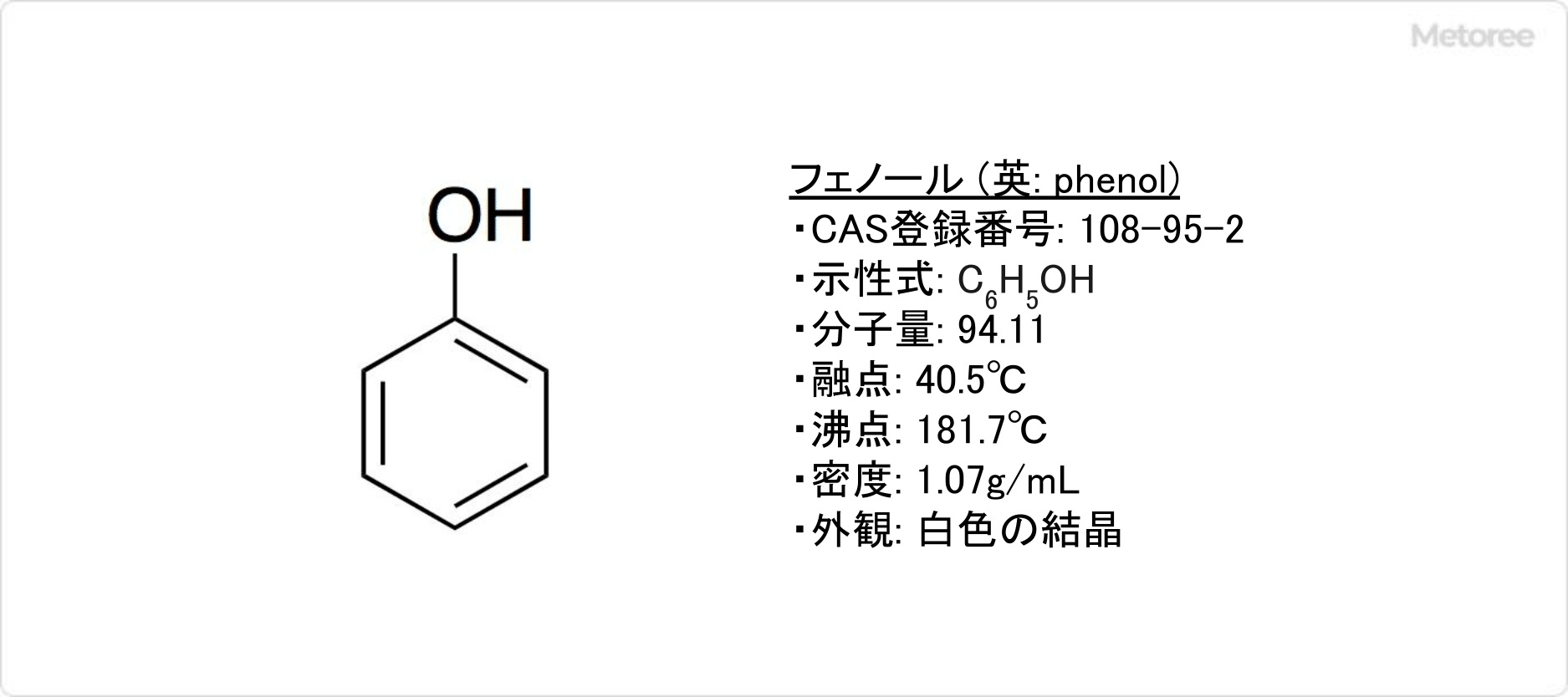
フェノールとは、1つのヒドロキシ基を持つ芳香族化合物です。
室温でフェノールは固体であり、特有の臭気を持つ無色の結晶です。フェノールは、古くはコールタールから得られていました。現在ではベンゼンを原料として、スルホン化法、塩素化法、クメン法等によって、フェノールが生成されています。
フェノールには、強力な殺菌効果があるものの、皮膚につくと腐食性を示すため毒性があり、取り扱いには注意が必要です。
フェノールの使用用途
フェノールは、フェノール樹脂やエポキシ樹脂の原料であるビスフェノールA、ポリカーボネート樹脂、ナイロン、カプロラクタム、アニリン等の原料として使用されています。その他にも、染料、界面活性剤、農薬、医薬、その中間体等、化学薬品の原料として幅広く使用可能です。
フェノールは、殺菌効果が強いことから、消毒・殺菌・防腐剤として用いることが可能です。消毒用に使用される際には、1~5%のフェノール水溶液が用いられます。
また、弱い知覚麻痺作用を有することから、痛みやかゆみを止める目的で配合されるといった用途もあります。
フェノールの性質
フェノールの密度は1.07g/cm3、融点は40.5°C、沸点は181.7°C、示性式はC6H5OH、分子量は94.11です。エタノールやジエチルエーテル等の有機溶媒に、よく溶けます。水にはやや溶けにくいです。アルコールのヒドロキシ基とは異なり、フェノールのヒドロキシ基は弱酸性を示します。
フェノールは広義だと、芳香環にヒドロキシ基が結合している化合物全般を指します。狭義には、フェノール類の中で、最も簡単な化合物のヒドロキシベンゼンのことを指します。つまり、ベンゼンの水素原子の1つが、ヒドロキシル基に置換された化合物のことです。
フェノールのその他情報
1. フェノールの共鳴効果とケト-エノール互変異性

図2. フェノールの共鳴効果とケト-エノール互変異性
フェノールの共役塩基のフェノキシドイオンは、芳香環の共鳴効果により安定化されています。ヒドロキシ基を有するアルコール類よりも、5桁以上も高い酸解離定数を示します。実際にフェノールの酸解離定数は、pKa = 9.95です。したがって、フェノールは弱酸性を示し、カチオン種と塩を形成します。フェノールの塩は、カチオン種名にフェノキシドを合わせて命名することが可能です。
また、フェノールからケト-エノール互変異性 (英: keto–enol tautomerism) により、シクロヘキサジエノン (英: cyclohexadienone) が生じると考えられます。しかし、ほとんどがエノール型の、フェノールとして存在します。脂肪族のエノールとは異なり、フェノールがケト型に変異した場合には、芳香族性を失う不安定化の影響が大きいためです。
2. フェノールの反応
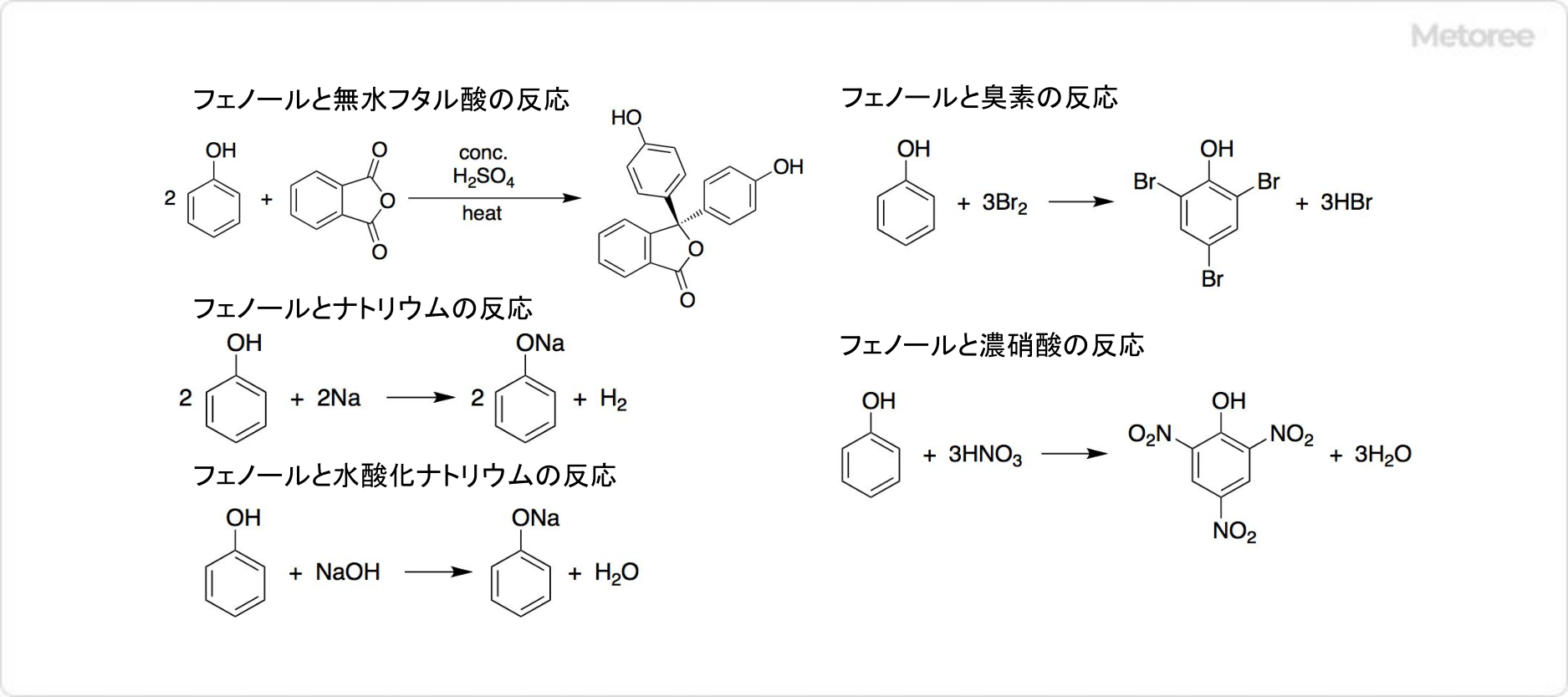
図3. フェノールの反応
フェノールはナトリウムや水酸化ナトリウムとの反応によって、ナトリウムフェノキシドを生じます。フェノールは無水フタル酸との縮合によって、フェノールフタレイン (英: phenolphthalein) を得ることが可能です。
臭素水溶液をフェノール水溶液へ加えると、2,4,6-トリブロモフェノール (英: 2,4,6-Tribromophenol) が合成されます。フェノールのニトロ化によって、ピクリン酸 (英: Picric acid) が生成可能です。ただしフェノールは濃硝酸で酸化されるため、まず濃硫酸でスルホン化してからニトロ化する必要があります。
3. フェノールの検出
フェノール性のヒドロキシ基を有する化合物は、塩化鉄 (III) 水溶液を用いて、簡易的に検出可能です。塩化鉄 (III) 水溶液を滴下すると、鉄フェノール錯体が生成して、赤紫色に変わります。Fe3+は6配位のイオンです。フェノキシドイオンが立体的にかさ高いため、[Fe(OC6H5)n(H2O)6-n]3-nのような錯体になっていると考えられています。