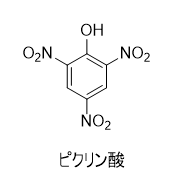
ピクリン酸とは
フェノール誘導体のニトロ化合物で、2,4,6-トリニトロフェノールの慣用名です。ピクリン酸という名前は、「苦い」を意味するギリシャ語「pikros」に由来しています。
CAS番号は88‐89‐1、融点は122.5℃、密度1.76g/cm3、発火点322℃で、常温においては淡黄色の結晶です。水や極性を持つ有機溶媒に可溶で、非極性溶媒には溶けにくいです。
ピクリン酸の性質
通常のフェノール類は弱酸性を示しますが、ピクリン酸の水溶液は強い酸性を示します。その理由は、ベンゼン環に強い電子求引基であるニトロ基が3つもついているため、プロトンを電離した後のアニオンが通常より大幅に安定化されるからです。
具体的に酸解離定数(pKa)を比較すると、フェノールのpKa 9.95に対し、ピクリン酸は0.38なので、かなり強酸性を示すことがわかると思います。
ピクリン酸は有毒性で、摂取すると下痢や嘔吐などを引き起こします。日本の消防法において、第5類危険物(自己反応性物質)に属しています。
 ピクリン酸は、加熱や衝撃によって爆発します。さまざまな金属と反応して、爆発性の塩を形成します。多くの有機化合物と反応して、ピクラートと呼ばれる塩を生成します。
ピクリン酸は、加熱や衝撃によって爆発します。さまざまな金属と反応して、爆発性の塩を形成します。多くの有機化合物と反応して、ピクラートと呼ばれる塩を生成します。
フェノール類の検出方法の一つに、塩化鉄(Ⅲ)による呈色反応が知られていますが、ピクリン酸はこの試薬による呈色反応を示しません。通常のフェノール類は、ベンゼン環の電子密度が高いためにフェノール性水酸基の酸素原子と鉄イオンが結合したような錯体を形成し、この部分が呈色反応を示します。
しかし、ピクリン酸では電子求引基であるニトロ基によってベンゼン環中の電子密度が低下して、その分フェノール性水酸基の酸素原子の非共有電子対の電子密度が下がり、鉄イオンへ配位しにくくなるという事が原因と考えられています。
ピクリン酸の使用用途
ピクリン酸は分子内にニトロ基を3つ持ち、ニトロ基は分解する際に多量の熱を放出するため、強い爆発性を持ちます。さらに、1つのニトロ基から熱が放出されると他のニトロ基も分解されるため連鎖的に発熱反応が発生します。
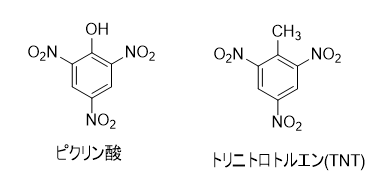
この性質を利用して、軍用の爆薬として使用されていました。1885年にフランス軍が軍用爆薬として用いると、各国へと広がりました。日本でも、日露戦争や太平洋戦争において砲弾や魚雷の爆薬として用いられ、下瀬(しもせ)火薬と呼ばれました。
しかし、爆薬としてのピクリン酸には、衝撃や摩擦に敏感すぎる、金属と反応して爆発性の塩を生成するなどの欠点があります。そのため今では爆薬として使われることは少なく、これらの欠点のないTNT(トリニトロトルエン)が、主要な爆薬として使われるようになりました。
 現在では、金属や有機化合物との反応性を利用して、生物組織標本作成用の固定液、酸塩基指示薬等の分析用試薬として用いられています。また、花火、農薬原料、染料、ガス脱硫触媒などに使用されています。
現在では、金属や有機化合物との反応性を利用して、生物組織標本作成用の固定液、酸塩基指示薬等の分析用試薬として用いられています。また、花火、農薬原料、染料、ガス脱硫触媒などに使用されています。
ピクリン酸のその他情報
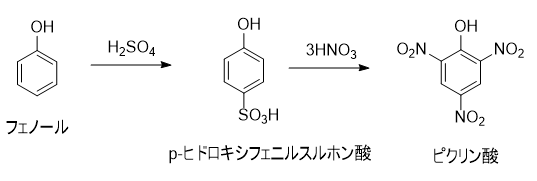
ピクリン酸は、フェノールのニトロ化反応で合成されてきました。
通常のニトロ化反応では、濃硫酸と濃硝酸を混合した混酸が用いられます。しかし、フェノールと混酸によるニトロ化では、酸化反応が優先して起きてしまうため、分子量の大きいタール状の物質が得られ、純度が低くなってしまいます。この副反応を抑えるため、まずフェノールと濃硫酸でスルホン化し、続いて濃硝酸でニトロ化する方法が取られている(スルホフェノール法)。
その他の合成法には、比較的安定なクロロジニトロベンゼンを加水分解して合成する方法などが存在します。
また、経口で摂取すると人体には毒性があり、皮膚や目にも強い刺激性を持つため、取り扱う際には十分に注意する必要があります。
保管する際には、施錠をして換気のよいところで保管する必要があり、廃棄する際には内容物や容器を都道府県知事の許可を受けた専門の廃棄物処理業者に委託して廃棄することが必要です。