アクロレインとは
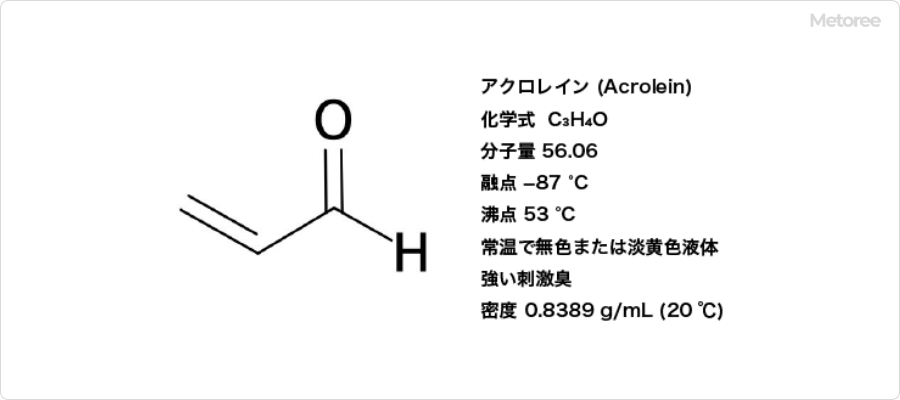
アクロレイン (Acrolein) とは、不飽和アルデヒドの一種であり、炭素-炭素二重結合を有する化合物です。
IUPAC命名法では2-プロペナール (2-propenal) と表記され、アクリルアルデヒド (acrylic aldehyde) やプロペンアルデヒド (propenaldehyde) などの慣用名も存在します。示性式はCH2=CHCHOです。分子量56.06、融点-88℃、沸点53℃であり、密度が0.8389 (20℃) の室温で無色またはわずかに黄色みがかった液体です。
アクロレインの使用用途
アクロレインは、さまざまな用途で使用されています。主な用途は、グリセリンやアリルアルコールの合成原料です。また、繊維処理剤や架橋結合剤としての利用もあり、メチオニンなどの医薬品の合成原料としても重要な役割を果たします。
その他、コロイド状オスミウム、ロジウム、ルテニウムの製造にも用いられ、溶剤や抽出剤としての用途もあります。かつては塗料に含まれる樹脂成分としても使用されていましたが、現在はシリコン樹脂塗料が主流となったため、ほとんど使用されていません。
また、人体においては脳梗塞を発症したときに血液中のアクロレイン濃度が上昇することが知られています。これは、脳梗塞によって血管が詰まり、周囲の細胞が損傷を受けたときに、細胞から漏れ出したポリアミンがポリアミンオキシダーゼによって分解されることで発生します。そのため、アクロレインは無症状性脳梗塞の検出を行うバイオマーカーとしても注目されています。
アクロレインの原理
アクロレインの原理を性質や合成方法、化学反応の観点から解説します。
1. アクロレインの性質
アクロレインは、最も構造が簡単な鎖式不飽和アルデヒド化合物であり、分子内に炭素-炭素二重結合とアルデヒド基を持ちます。アクロレインは反応性が非常に高く、容易に重合して樹脂状の固体となります。特に光、アルカリ、強酸の存在下では不安定であり、空気中でも酸化や重合が進むため、安定剤としてヒドロキノンなどの重合禁止剤が使用されることがあります。
強い刺激臭を持ち、水にも可溶で、溶解度は20℃で20g/100mLです。また、アクロレインは油脂が熱分解される際に生成され、有毒であると同時に引火性が高い特性を持ちます。熱や火花によって容易に発火するため、取り扱いには十分な注意が必要です。法規制も厳しく、以下のように指定されています。アクロレインは高い危険性を伴うため、適切な管理が求められます。
- 毒物及び劇物取締法:劇物
- 消防法:第4類引火性液体、第一石油類非水溶性液体
- 労働安全衛生法:有害物表示対象物
2. アクロレインの合成方法
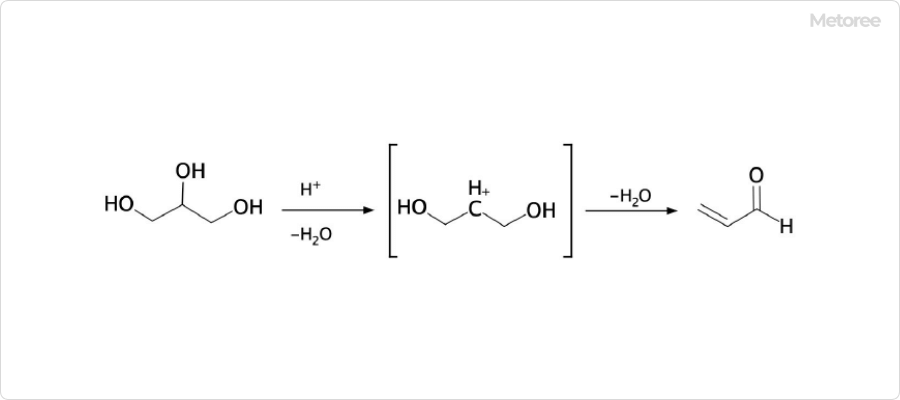
図2. アクロレインの一般的な合成方法
アクロレインの合成には、実験室的手法と工業的手法があります。実験室における一般的な方法は、グリセリンを硫酸水素カリウムなどの脱水剤を使って脱水する手法です。工業的な方法では、高温のグリセリン蒸気を硫酸マグネシウムに通じて合成するプロセスが一般的です。これにより、大量生産が可能になります。
3. アクロレインの化学反応
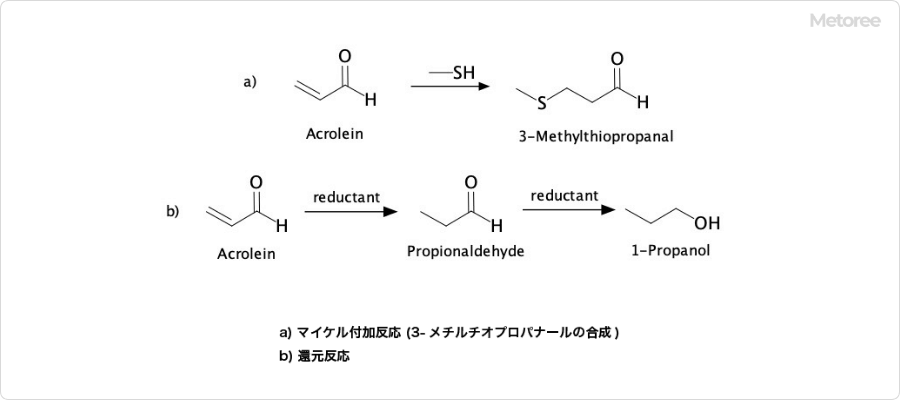
図3. アクロレインの反応の例
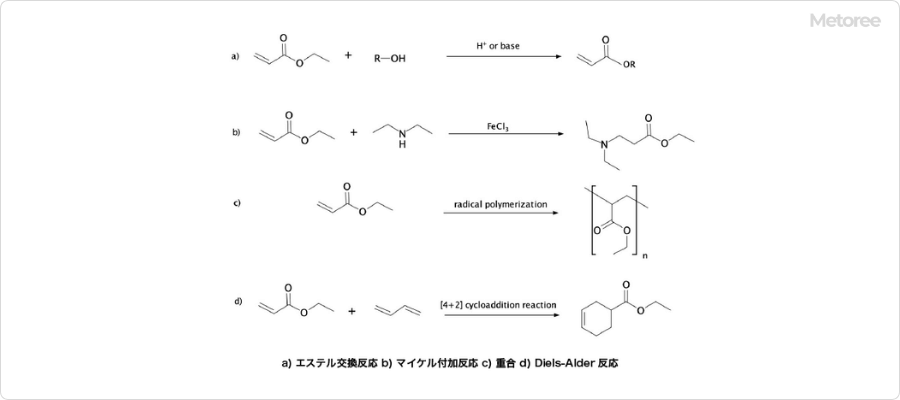
アクロレインはα,β-不飽和カルボニル化合物であり、求核剤の1,4-付加を受けやすい性質を持ちます。代表的な反応の一つに、マイケル付加反応のアクセプターとしての利用があり、例えばメチオニンの合成過程で3-メチルチオプロパナールを生成する際に関与します。
また、アクロレインを還元すると、まずプロピオンアルデヒドが生成され、その後プロパノールへと変化します。これは、アルデヒド基よりも先にオレフィン部分が還元されるためです。
アクロレインの種類
アクロレインは不安定な化合物であるため、市場で販売されることはほとんどありません。ただし、研究用試薬としては流通しており、以下のような形態で販売されています。
- 100μg/mLまたは10mg/mL水溶液
- 100μg/mLまたは1,000μg/mLのメタノール:水=9:1溶液
- 5.0mg/mLパラジオキサン溶液
アクロレインは非常に不安定であるため、通常は冷蔵または冷凍で保存されます。重合体や酸化体が生成し、液体が濁ることもあるため、その場合は蒸留などによって精製し、速やかに使用する必要があります。