クロロアセトフェノンとは
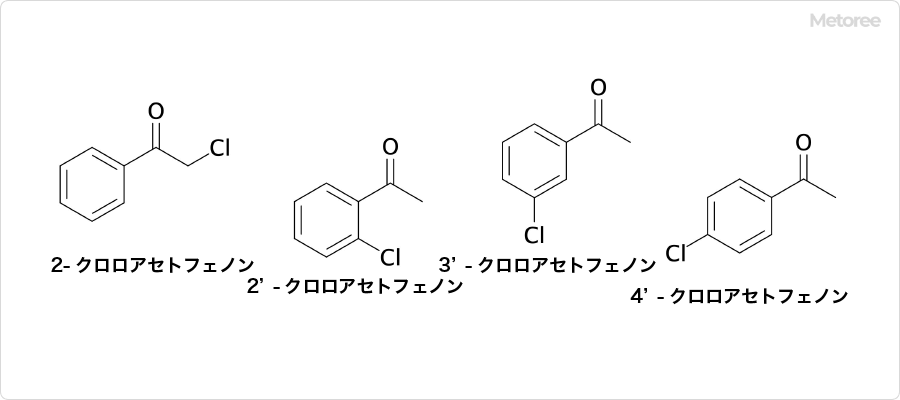
クロロアセトフェノン (英: Chloroacetophenone) とは、分子式C8H7ClOで表される分子量154.59の有機化合物です。
2-クロロアセトフェノン、2′-クロロアセトフェノン、3′-クロロアセトフェノン、4′-クロロアセトフェノンなどの位置異性体が存在します。CAS登録番号は、 2-クロロアセトフェノン: 532-27-4、2′-クロロアセトフェノン: 2142-68-9、3′-クロロアセトフェノン: 99-02-5、4′-クロロアセトフェノン: 99-91-2です。
2-クロロアセトフェノンは、催涙剤の一種として用いられ、別名には、塩化フェナシル、CNガスなどの名称があります。
クロロアセトフェノンの使用用途
2-クロロアセトフェノンは、強力な催涙作用があります。このため、防犯グッズや化学兵器の分野において、催涙スプレーや催涙弾の原材料として使用されています。主に暴動鎮圧を目的として、1918年米国で開発されました。今日でも世界各国の警察が暴徒鎮圧用として使用しており、日本の警察も保有しているとされています。その他には、農薬、医薬等の中間体としての用途もあります。
4′-クロロアセトフェノンも 医薬・染料中間体として活用されており、こちらは2-クロロ体に比べて刺激性、催涙性が少ないとされています。
クロロアセトフェノンの性質
1. 2-クロロアセトフェノンの基本情報

図2. 2-クロロアセトフェノンの基本情報
2-クロロアセトフェノンは、融点54-59℃、沸点244~245℃であり、常温では白色の結晶固体です。リンゴの花のような匂いが特徴です。密度は、1.3g/mLであり、水への溶解度は1.64g/100mL (25℃) です。水に溶けにくく、エタノール、エーテル、ベンゼンに溶けやすい性質があります。
労働安全衛生法では、 名称等を通知すべき危険物及び有害物に指定されています。
2. 2-クロロアセトフェノンの合成
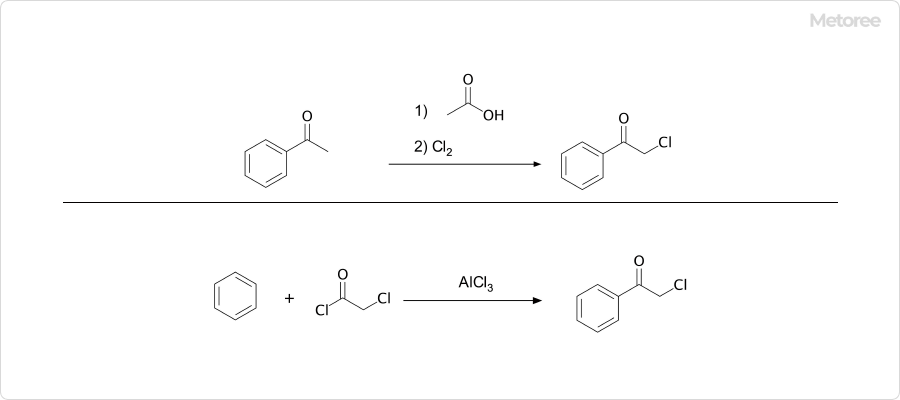
図3. 2-クロロアセトフェノンの合成
2-クロロアセトフェノンは、アセトフェノンと氷酢酸を混ぜて加熱攪拌し、生成物を冷却して塩素ガスを吹き込むことで合成できます。別の合成法には、ベンゼンとクロロアセチルクロリドを原料とし、塩化アルミニウムを触媒としてフリーデル・クラフツ反応により生成する方法があります。
3. 2-クロロアセトフェノンの催涙作用
クロロアセトフェノンは目、喉、および皮膚に対して強い刺激をもたらす物質です。視力のぼやけ、鼻、喉、皮膚の刺激および灼熱、および呼吸困難、焼き付くような胸部の痛み、目の痛みを引き起こす作用があります。
これらの効果は一時的であり一般的には30分程度で症状は治まりますが、角膜損傷や皮膚の化学火傷症状が起きる可能性もあります。
4. 4′-クロロアセトフェノンの基本情報
4′-クロロアセトフェノンは、融点20℃、沸点232℃であり、常温では淡い麦わら色の液体、もしくは白色の固体です。密度は1.190g/mLであり、エタノール及びエーテルに極めて溶けやすく、水にほとんど溶けません。2-クロロアセトフェノンに比べて催涙作用が弱いという特徴があります。
引火性が有り、引火点は90℃です。消防法では、第4類引火性液体、第三石油類非水溶性液体に指定されています。
クロロアセトフェノンの種類
クロロアセトフェノンは、前述の通り化合物としては2-クロロアセトフェノン、2′-クロロアセトフェノン、3′-クロロアセトフェノン、4′-クロロアセトフェノンなど、複数種類の位置異性体が存在します。
これらは、主に研究開発用試薬製品として販売されています。5g、25g、100g、500gなどの容量の種類があり、実験室で取り扱いやすい容量での提供です。また、重水素置換された2-クロロアセトフェノン-d5も販売されています。