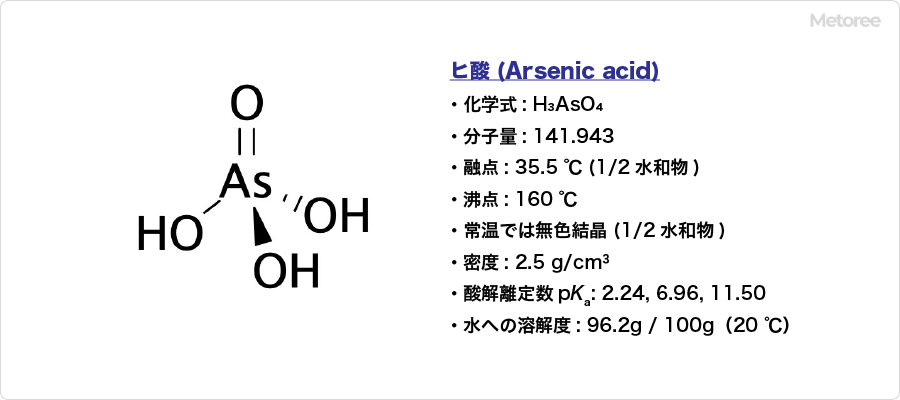
水酸化亜鉛とは
水酸化亜鉛は、亜鉛の水酸化物で、化学式は Zn(OH)2 です。両性の水酸化物で、酸にもアルカリにも溶解するが、水にはほとんど溶けない白色で粉末状の化学物質です。酸に溶けて亜鉛塩となり、アルカリに溶けると亜鉛酸塩になります。また、125℃まで加熱すると分解して酸化亜鉛になります。
水酸化亜鉛は、水酸化アルカリを亜鉛酸水溶液に加えると白色の沈殿物となって得られます。水酸化亜鉛は、α,β,γ,δ,ε形の5つの変態があり、このうちε形が斜方晶系の結晶です。
水酸化亜鉛の使用用途
水酸化亜鉛は、ゴムの製造の際に配合剤として使われます。また、外科用包帯の吸収剤や酸化亜鉛などの製造にも使用されます。この他、亜鉛とアルミニュウム膜の二層水酸化物を電気化学法で合成する際に、水酸化亜鉛が使用されます。また、水酸化亜鉛と水酸化ナトリウムを混合することにより、亜鉛塩を作ります。
水酸化亜鉛の派生品の用途としては、酸化亜鉛はゴムの加硫促進助剤や染料、乾燥剤、医薬品、化粧品などに広く使われています。塩化亜鉛は、溶融亜鉛メッキのフラックス剤やマンガン乾電池の電解液として使用されます。さらに、硫酸亜鉛は、農薬や 肥料に多く使用されています。
水酸化亜鉛の性質
1. 両性水酸化物
水酸化亜鉛は両性水酸化物で、酸性の水溶液にも強塩基の水溶液にも溶けます。例えば、塩酸を加えると塩化亜鉛となり水に溶けます。水酸化ナトリウム水溶液を過剰に加えると、テトラヒドロキシド亜鉛 (Ⅱ) 酸イオン [Zn(H2O)4]2+ を生じて溶けます。
- 塩酸との反応
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O - 多量の水酸化ナトリウムとの反応
Zn(OH)2 + 2NaOH → 2Na+ + [Zn(H2O)4]2-
この特性は、亜鉛イオンを検出するためのテストとして使用することができます。ただし、アルミニウムや鉛の化合物も同様の反応を示すため、排他的ではありません。
アンモニアとの反応
また、水酸化亜鉛にアンモニア水を過剰に加えると、 Zn2+ にアンモニア分子4個が配位結合して、無色のテトラアンミン亜鉛 (Ⅱ) イオン [Zn(NH3)4]2+ を生じて溶けます。これは両性水酸化物としての性質ではなく、 Zn2+ が NH3 分子と錯イオンを作りやすいという性質に基づくものです。
- アンモニアとの反応
Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+ + 2OH–
Zn(OH)2に過剰にアンモニア水を加えると、Zn2+ に対するH2OとNH3 の交換反応が起こり、水溶液中に [Zn(NH3)4]2+ が生成し始めます。そのため、 [Zn(H2O)4]2+ が減少するので、これを補うようにZn(OH)2が溶解します。両性金属 (Al、Zn、Sn、Pb) のイオンの中で、アンモニアと錯イオンをつくるのはZn2+ だけです。
水酸化亜鉛の構造
水酸化亜鉛のε-相は斜方晶系の結晶であり、亜鉛の周りには4つのOH基が正四面体状に配位しています。また、OH基の周りは2つの亜鉛原子と2つのOH基が存在しており、巨大な分子構造を形成しています。α−相は六方晶系の水酸化カドミウム型構造になっています。
また、テトラヒドロキシド亜鉛 (Ⅱ) 酸イオン [Zn(H2O)4]2+ は Zn2+ を中心とした錯イオンで、正四面体構造をとっています。
水酸化亜鉛のその他情報
1. 水酸化亜鉛の製造
硫酸亜鉛の水溶液に、水酸化ナトリウム水溶液を加えると、無定形コロイド状の白色沈殿である水酸化亜鉛が得られます。また、熱濃水酸化ナトリウム水溶液に酸化亜鉛を溶解させた後、希釈し、2〜3週間寝かせると、ε−相の水酸化亜鉛の結晶が沈殿します。
- 硫酸亜鉛から
ZnSO4 + 2NaOH → Zn(OH)2 + Na2ZnSO4 - 酸化亜鉛から
ZnO + 2OH– + H2O → [Zn(H2O)4]2-
[Zn(OH)4]2- → Zn(OH)2 + 2OH–
2. 水酸化亜鉛の安全性情報
水酸化亜鉛が目や皮膚に接触した場合、重度の刺激によって損傷を与える可能性があります。目に入った場合は数分間注意深く洗い流し、皮膚についた場合は石鹸でよく洗うことが大切です。
水酸化亜鉛はGHS分類では、水生環境有害性が「区分1」(非常に強い毒性) とされており、環境にたいする有毒性が強い物質のため取り扱いには注意が必要です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen_pg/KAG_DET.aspx?joho_no=27947
https://www.nite.go.jp/chem/chrip/chrip_search/
https://www.yone-yama.co.jp/shiyaku/msds/pdfdata/CC0006.pdf