ヒ酸とは
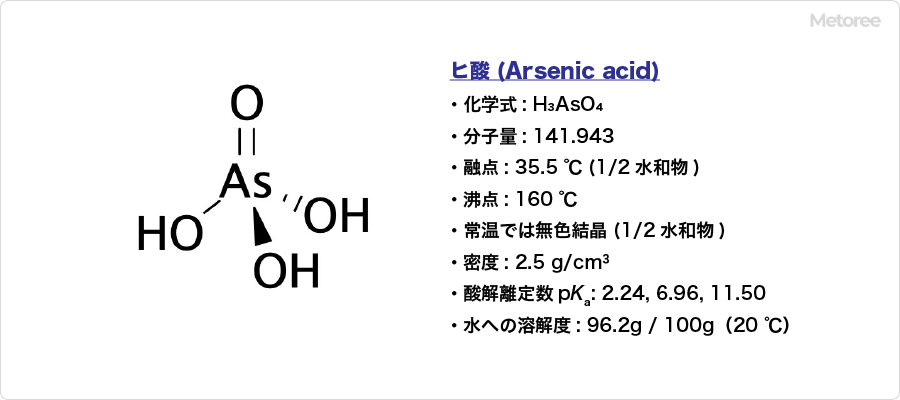
図1. ヒ酸の基本情報
ヒ酸 (Arsenic acid) とは、ヒ素のオキソ酸の一種である無機化合物です。
化学式H3AsO4で、別名にはオルトヒ酸 (Orthoarsenic acid) という名称があります。CAS登録番号は7778-39-4です。
式量は141.943、融点は35.5℃ (1/2水和物)、融点は160℃であり、常温では無色結晶 (1/2水和物) です。密度は2.5 gcm-3、水への溶解度は96.2g /100g (20℃) となっており、水に溶けやすい物質です。酸解離定数pKaは、2.24, 6.96, 11.50です。
亜ヒ酸ほど強くはないものの、毒性は極めて強く、ヒ酸およびヒ酸塩は医薬用外毒物に指定されています。労働安全衛生法においては、砒素及びその化合物として名称等を表示すべき危険物及び有害物に指定されている化合物です。
ヒ酸の使用用途
ヒ酸の主な用途は、殺虫剤、殺鼠剤の他、有機色素工業における利用、有機および無機のヒ素製剤の原料があります。特に、殺虫剤としてはシロアリの駆除などに使用されてきました。しかし、有毒性が高く環境汚染や健康被害が問題となったため、現在は日本では使用することができません。
ヒ酸は、1/2水和物が無色結晶として単離されていますが、これは吸湿性で水に極めて溶解しやすい物質です。潮解性の高さから水溶液や水和物の状態で用いられたり、あるいは亜ヒ酸が使用されることが多くあります。
ヒ酸の特徴
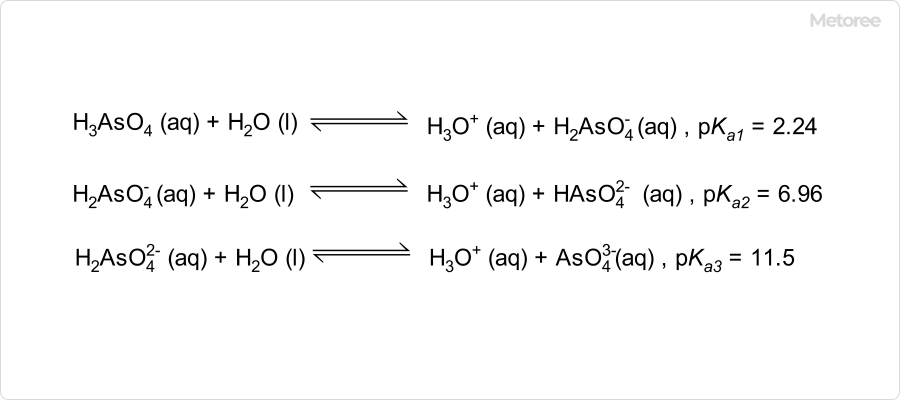
図2. ヒ酸水溶液の電離平衡
ヒ酸の無水物及び0.5水和物は、吸湿性で潮解しやすい物質です。無水物結晶は水に対しやや吸熱的に溶解するとされます。また、ヒ酸においてヒ素原子の酸化数は+V (+5) と最高酸化状態であり、3価の酸としての性質を示す物質です。
このような点は、リン酸と類似していると言えます。潮解性をもち、水にも可溶なことから、保管の際には密閉した状態を保つことが重要です。
ヒ酸の水溶液は、3段階の電解を起こす弱酸です。第一段階電離により、ヒ酸二水素イオン (H2AsO4-) 、第二段階解離によりヒ酸水素イオン (HAsO42-) 、第三段階解離によりヒ酸イオン (AsO43-) を生成します。ヒ酸イオンは正四面体型構造でありリン酸イオンに類似しています。
電解の一段目はやや強く解離し、0.1mol dm-3の水溶液では電離度は約0.25です。2段目以降は逐次減少し、酸性水溶液中の解離は無視できるとされています。
ヒ酸の種類
ヒ酸そのものは潮解性が高く、取り扱いが難しいため無水物での製品販売は基本的にはありません。ヒ酸溶液として60%程度の濃度で販売されている他、固体では塩の状態で販売されています。基本的には、研究開発用の薬品や工業用の薬品として販売されます。
ヒ酸塩として最も一般的なものは、ひ酸水素二ナトリウム七水和物 (Na2HAsO4・7H2O) です。この物質は、常温では白色の結晶または結晶性粉末で、水に溶けやすく、エタノールにほとんど溶けません。室温保管可能な試薬製品として取り扱われ、アルカロイドの検出試薬などの用途があります。
ヒ酸のその他情報
1. ヒ酸の製法
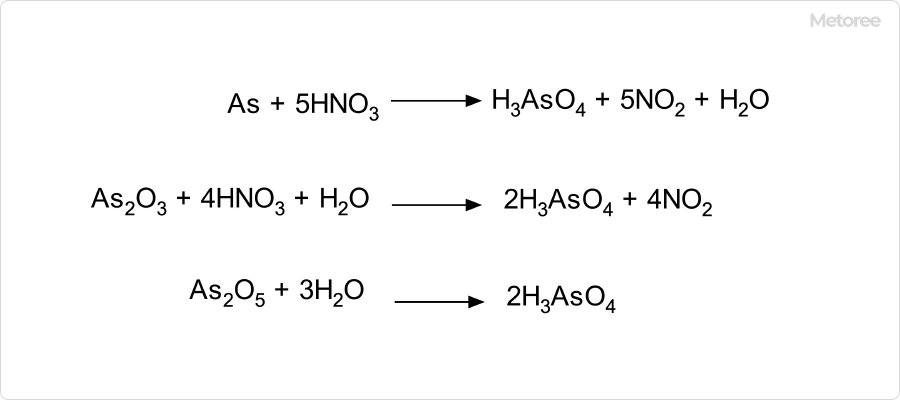
図3. ヒ酸の製造方法
ヒ酸の製造方法は、単体ヒ素または三酸化二ヒ素の濃硝酸による酸化です。この溶液を濃縮すると29.5℃以下で0.5水和物の細かい板状結晶が析出し、29.5℃以上ならば三ヒ酸 (H5As3O
10) が析出します。
また、別の方法では、五酸化二ヒ素を水に溶かすことで得られます。
2. ヒ酸の化学反応
ヒ酸の水溶液は弱い酸化作用を示し、例えば、ヨウ化物イオンをヨウ素に酸化します。また、ヒ酸は穏やかな加熱により脱する物質です。三ヒ酸 (H5As3O10) を生成し、さらに加熱すると250℃から五酸化二ヒ素となりますが、完全な脱水には500 ℃以上の高温が必要であるとされています。
二ヒ酸 (H4As2O7) あるいはポリヒ酸 (Hn+2AsnO3n+1、(HAsO3)n) およびそのイオンは水溶液中では不安定であり、速やかに加水分解され、ヒ酸あるいはヒ酸イオンとなります。