オキセタンとは
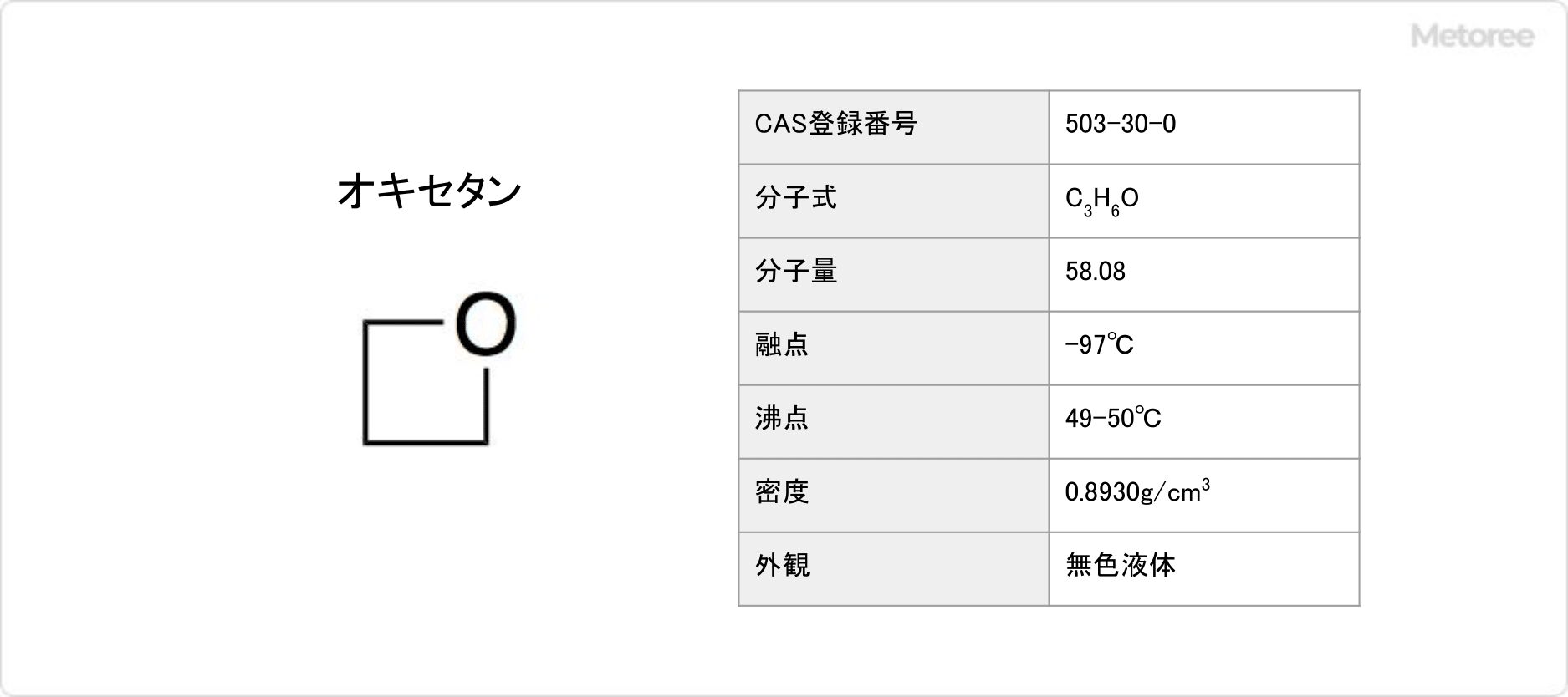
オキセタンとは、飽和の4員環に酸素を1個持つ構造の環状エーテルです。
別称、トリメチレンオキシド、酸化トリメチレン、オキサシクロブタン、3-ヒドロキシ-3-ブテン酸ラクトン、4-メチレンオキセタン-2-オン、1,3-エポキシプロパンと呼ばれます。
有機化学の分野では、オキセタンの4員環構造を指して「オキセタン」や「オキセタン環」と呼ぶ場合もあります。
オキセタンの使用用途
オキセタンは、医薬品原料、染料原料、防腐剤原料に用いられます。有機合成では、アミン、アルコール、ベンゼンのヒドロキシプロピル化に利用可能です。
オキセタンを含む各種誘導体は、エポキシ樹脂の高速硬化やプラスチック材料に対する優れた密着性のような特徴を持つため、エポキシ樹脂用添加剤に使用され、塗料、接着剤、各種コーティング剤などの用途があります。柔軟性や密着性に優れるほか、環境にやさしい材料として注目を浴びています。
オキセタン環を有する化合物の中には、抗ウイルス剤や血小板凝集に関わる物質、抗がん剤などの生化学的特徴を持つものも多いです。
オキセタンの性質
オキセタンの融点は−97°C、沸点は49〜50°Cであり、特有の匂いを持つ無色の液体です。有機溶媒に溶けやすく、水と混和します。
オキセタン環は歪みエネルギーが高く、求核剤と反応して容易に開環します。アミンやアルコールのほか、フリーデル・クラフツ触媒 (英: Friedel–Crafts Catalyst) の存在下でベンゼンをヒドロキシプロピル化するために使用可能です。
オキセタンの構造
オキセタンの化学式は、C3H6Oまたは(CH2)3Oで表されます。分子量は58.08g/mol、密度は0.8930g/cm3です。
オキセタンのような環状エーテルの例として、炭素原子を2個持つ三員環化合物のエチレンオキシド (オキシラン) が挙げられます。そのほか、炭素原子を4個持つ五員環化合物のテトラヒドロフラン (THF、テトラメチレンオキシド) 、炭素原子を5個持つ六員環化合物テトラヒドロピラン (THP、ペンタメチレンオキシド) などもあります。
オキセタンのその他情報
1. オキセタンの合成法
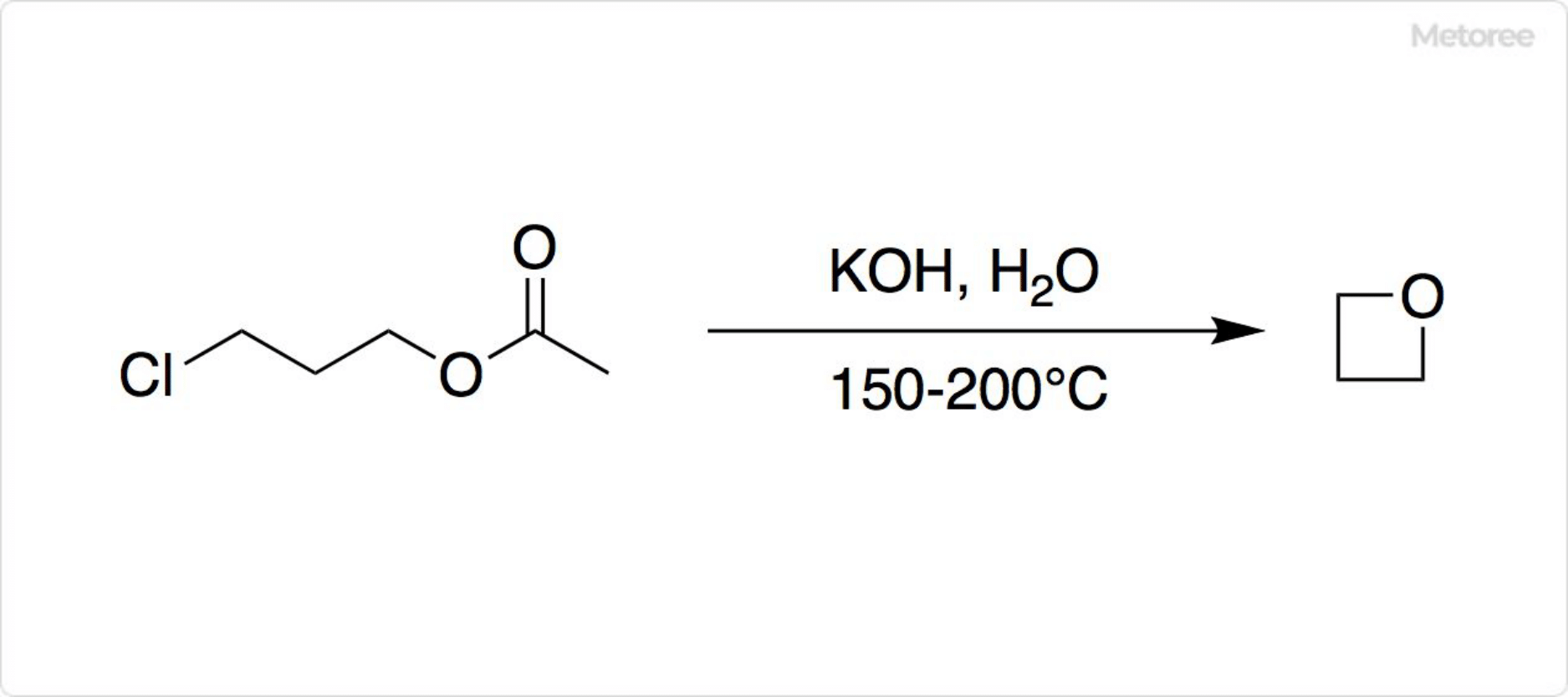
図2. オキセタンの合成
150°Cで水酸化カリウムと酢酸3-クロロプロピルが反応すると、オキセタンが得られます。さまざまな副生生物が生じるため、収率は40%です。
パターノ・ビューチ反応 (英: Paternò–Büchi reaction) でもオキセタンを合成可能です。カルボニル化合物とアルケンに紫外光を照射すると、[2+2]環化が進行してオキセタン環が生成します。
ジオールの環化や6員環状カーボネートの脱炭酸でも、オキセタン環を合成できます。
2. オキセタン環を含む天然化合物
オキセタン環を持つ天然物はあまり多くありませんが、代表例はβ-アミノ酸であるオキセチンです。オキセチンはオキセタン環上に、カルボキシ基とアミノ基を有します。
オキセタノシンAは、オキセタン環にヒドロキシメチル基を2個有し、アデニンが置換された構造を持っています。アデニンの代わりにチミンやグアニンを有する類縁体も合成されており、オキセタノシンTとオキセタノシンGです。
オキセタン環を有するテルペノイド (英: Terpenoid) には、タキソール、クレメンテイン、テウクロキシドなどが知られています。
3. オキセタン環を有する関連化合物
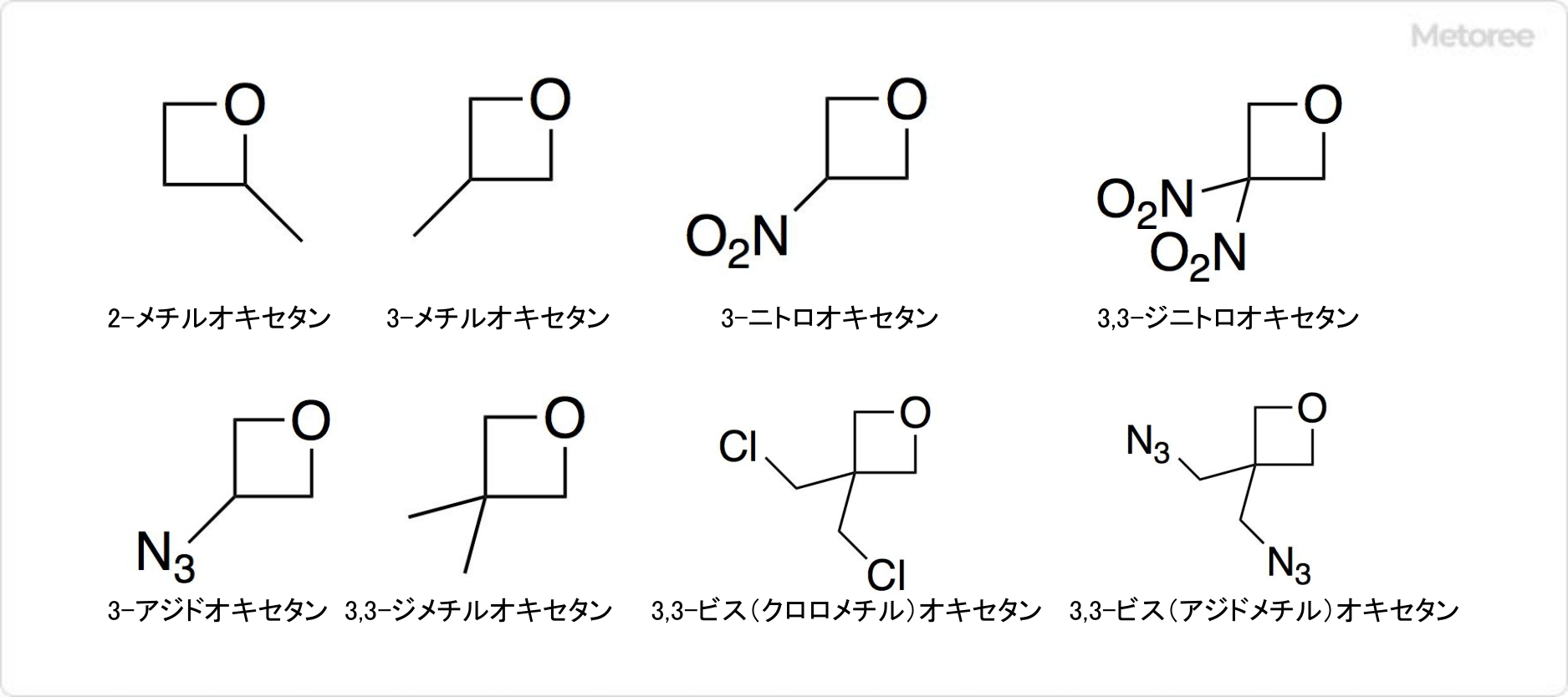
図3. オキセタンの関連化合物
オキセタン環を有する100種類以上の化合物が合成されています。具体例として、メチル基を持つ2-メチルオキセタンや3-メチルオキセタン以外にも、ニトロ基を有する3-ニトロオキセタンや3,3-ジニトロオキセタンなどが挙げられます。
そのほか、3-アジドオキセタン、3,3-ジメチルオキセタン、3,3-ビス (クロロメチル) オキセタン、3,3-ビス (アジドメチル) オキセタンなどもあります。