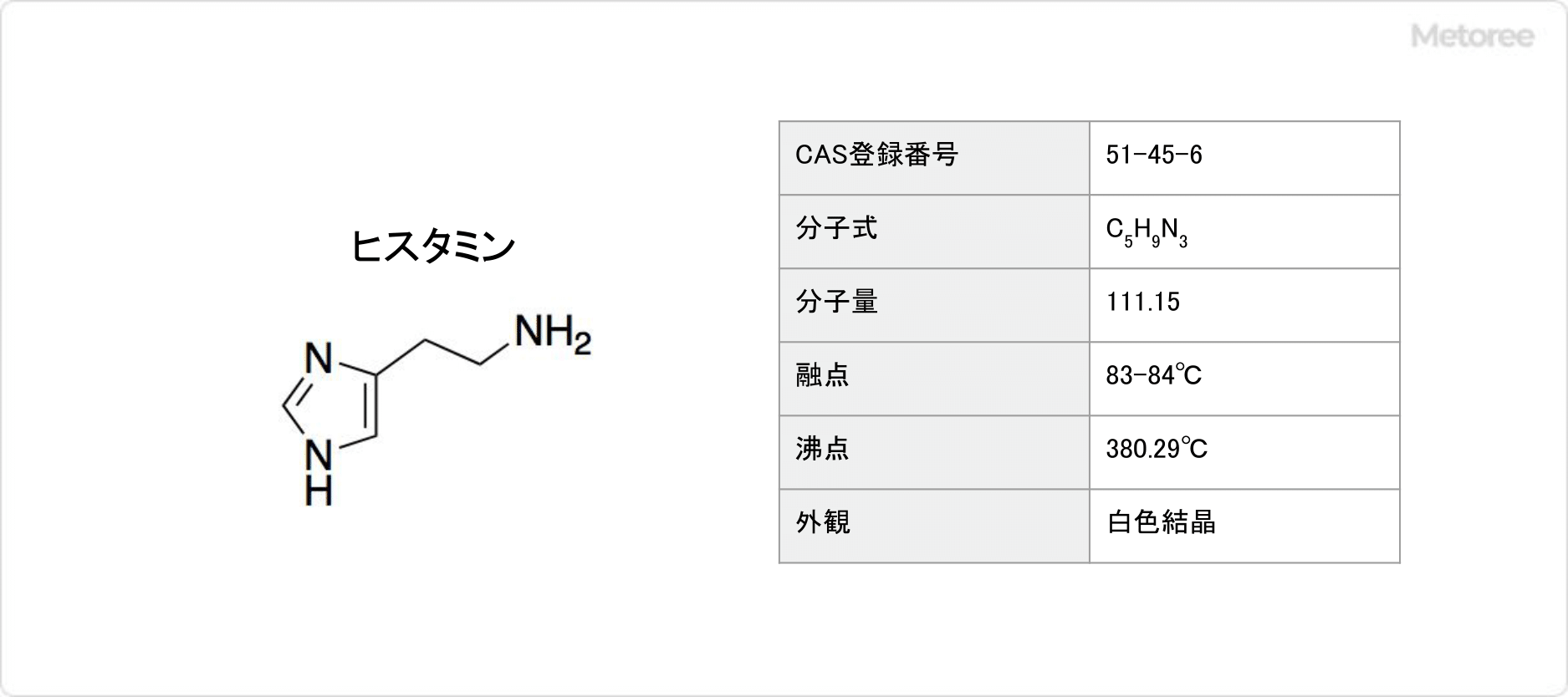
安息香酸メチルとは
安息香酸メチル (英: Methyl benzoate) とは、芳香を持つ無色の液体です。
IUPAC名は、安息香酸メチル (英: Methyl benzoateまたは、Methyl benzenecarboxylate) 、英語の別名としてMethylbenzoate、Benzoic acid methyl ester、Niobe oilとも呼ばれます。
化学式C8H8O2で表され、分子量136.15の有機化合物です。CAS登録番号は93-58-3です。なお、消防法による第4類危険物、および第3石油類に該当します。
安息香酸メチルの使用用途
安息香酸メチルは、フルーティーな香りのあるエステル化合物で、天然にはグアバやマンゴーおよびキウイフルーツに含まれます。その特徴的な香りから、食品のフレーバーやイランイラン系の香料・香水などに使用されています。
また、合成樹脂、セルロースエステルやゴムの溶剤、ポリエステル繊維の染色助剤、殺菌剤や農薬への添加剤などさまざまな用途で使用可能です。ランミツバチの雄は、植物から安息香酸メチルを採取し、フェロモンの合成に使用していることが知られています。
化学合成では、前駆体として次のような反応に利用されています。
- 担持酸化マンガン触媒を用いたベンズアルデヒドの選択的合成
- フリーデル‐クラフツアシル化を介したアリール化合物との反応によるベンゾフェノン誘導体の生成
安息香酸メチルの性質
融点は−15°C、沸点は199.6°C、引火点82℃、常温で密度1.094g/cm3の液体です。安息香酸メチルは親油性で、エタノールやアセトンには極めて溶けやすく、水には溶けにくい性質を持ちます。
安息香酸メチルは、用いる反応剤によって環とエステルの両部位での反応が可能です。例えば、酸触媒下、求電子剤である硝酸を用いると、3-ニトロ安息香酸メチルが生成します。
求核剤はカルボニル炭素を攻撃するため、安息香酸メチルをNaOH水溶液で加水分解すると、安息香酸ナトリウムが得られます。
安息香酸メチルのその他情報
1. 安息香酸メチルの製造法
フィッシャーのエステル化法により、硫酸など少量の強酸触媒下、メタノール溶液中で安息香酸と反応させることで合成できます。
自然界では、水生植物の一種オオサンショウモから単離されます。
2. 取り扱い及び保管上の注意
取り扱う場合
安息香酸メチルは、可燃性の液体です。高温のものや裸火、火花などの着火源から離れて使用します。また、静電気放電により安息香酸メチルの蒸気に引火する可能性があります。
アースを取るなど、静電気を避けるための措置が必要です。局所排気装置であるドラフトチャンバー内で使用します。使用の際は、個人用保護具を着用します。
火災の場合
火災が生じた場合、安息香酸メチルの熱分解で、分解して二酸化炭素や一酸化炭素を発生させる恐れがあります。消火には水噴霧や泡消火剤、粉末消火剤、炭酸ガス、消化砂などを使用します。
皮膚に付着した場合
皮膚に付着しないよう注意が必要です。使用時は必ず白衣や作業着などの保護衣や保護手袋を着用し、保護衣の袖は決して捲らず、皮膚が暴露しないようにします。
万が一皮膚に付着した場合は、石けんと大量の水で洗い流します。衣類に付着した場合は、汚染された衣類をすべて脱いで隔離が必要です。皮膚刺激が生じた場合は、医師の診療を受けることをおすすめします。
眼に入った場合
使用時は、必ず保護メガネまたはゴーグルを着用します。万が一眼に入った場合は、水で数分間注意深く洗います。
コンタクトを着用している場合で簡単に外せるときは外し、しっかり洗浄します。眼の刺激が持続する場合は、医師の診察を受けた方が無難です。
保管する場合
保管する際は、ガラス製容器に入れて密閉します。直射日光を避け、換気がよく、なるべく涼しい場所が最適です。混触危険物質である強酸化剤との接触は避けるようにします。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/93-58-3.html
https://labchem-wako.fujifilm.com/sds/W01W0113-0199JGHEJP.pdf
https://pubchem.ncbi.nlm.nih.gov/compound/Methyl-benzoate