塩素酸ナトリウムとは
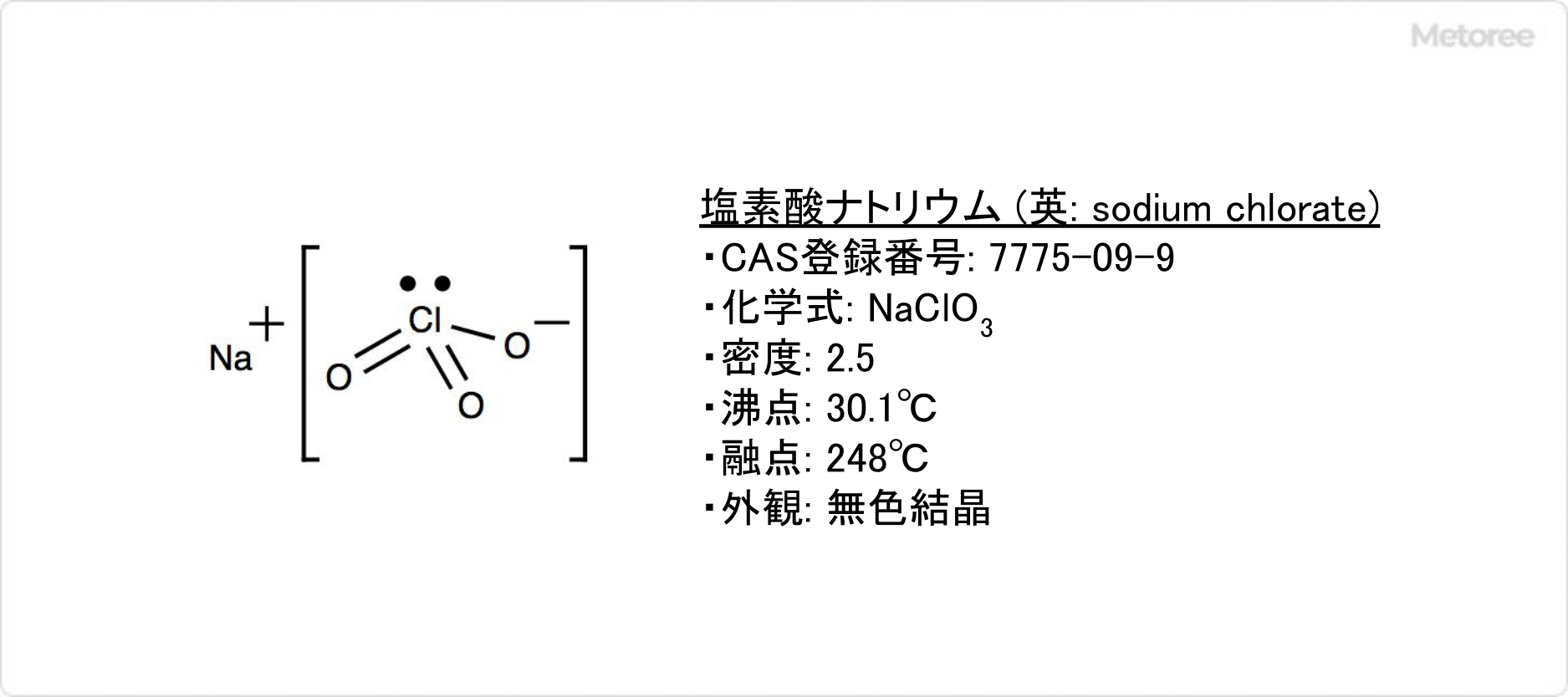
塩素酸ナトリウムとは、塩素酸のナトリウム塩です。
塩素酸ソーダとも呼ばれています。潮解性がある無色の結晶です。有機物のような可燃性物質が混入することで、爆発する恐れがあります。
また、消防法では「第1類危険物」に、毒劇物取締法では「劇物」「発火性または爆発物のある劇物」に、労働安全衛生法では「危険物・酸化性の物」に、それぞれ指定されており、取り扱いには注意が必要です。
塩素酸ナトリウムの使用用途
塩素酸ナトリウムは、重要な工業薬品であり、二酸化塩素・亜塩素酸塩・過塩素酸塩の製造原料として用いられています。二酸化塩素はパルプの漂白剤として、亜塩素酸ナトリウムは繊維漂白剤として利用可能です。
また、単体でも優れた非選択性除草剤として利用されています。さらに、酸化剤として、染色や電解加工などの他、ウラン鉱からの酸性浸出にも用いられています。
その他にも、塩素酸ナトリウムは、「マッチ」「花火」「爆薬」「殺虫剤」「印刷インキ」「染料」「化粧品原料」「織物加工」「製紙」「皮なめし」などに使用可能です。
塩素酸ナトリウムの性質
塩素酸ナトリウムは、きわめて水に溶けやすいです。水溶液は中性で、強酸と反応すると二酸化塩素を放出します。
光で分解するため、褐色の瓶に密栓して保管するか、冷暗所に保管する必要があります。
融点は248℃です。酸性溶液中では強い酸化剤となり、300℃以上で酸素を放って分解します。有機物、金属粉、硫黄が混じると、加熱や摩擦衝撃などで爆発します。
塩素酸ナトリウムの構造
塩素酸ナトリウムは無色無臭の結晶です。化学式はNaClO3、モル質量は106.44で、密度は2.5です。構造は+5価の塩素原子が3個の酸素原子を持った形を取っています。
塩素酸ナトリウムのその他情報
1. 塩素酸ナトリウムの合成法
塩素酸ナトリウムは、水酸化ナトリウムの熱溶液に塩素を吹き込んで酸化することによって生成します。工業的に主流の方法は、塩化ナトリウム飽和溶液の電気分解です。
ただし、電気分解の際に、食塩水電解用の寸法安定性電極のほか、耐酸化性のある白金、黒鉛、二酸化鉛などが陽極に必要です。pHや温度も重要で、高pHや低温条件では次亜塩素酸ナトリウム (NaClO) が生成します。
実験室では、次亜塩素酸ナトリウム (NaClO) の不均化でも、塩素酸ナトリウムが得られます。ナトリウム塩とさらし粉を反応させ、加熱することによって生成可能です。いずれの反応においても、収率には水溶液のpHが大きく影響を与えます。
2. 塩素酸塩の特徴
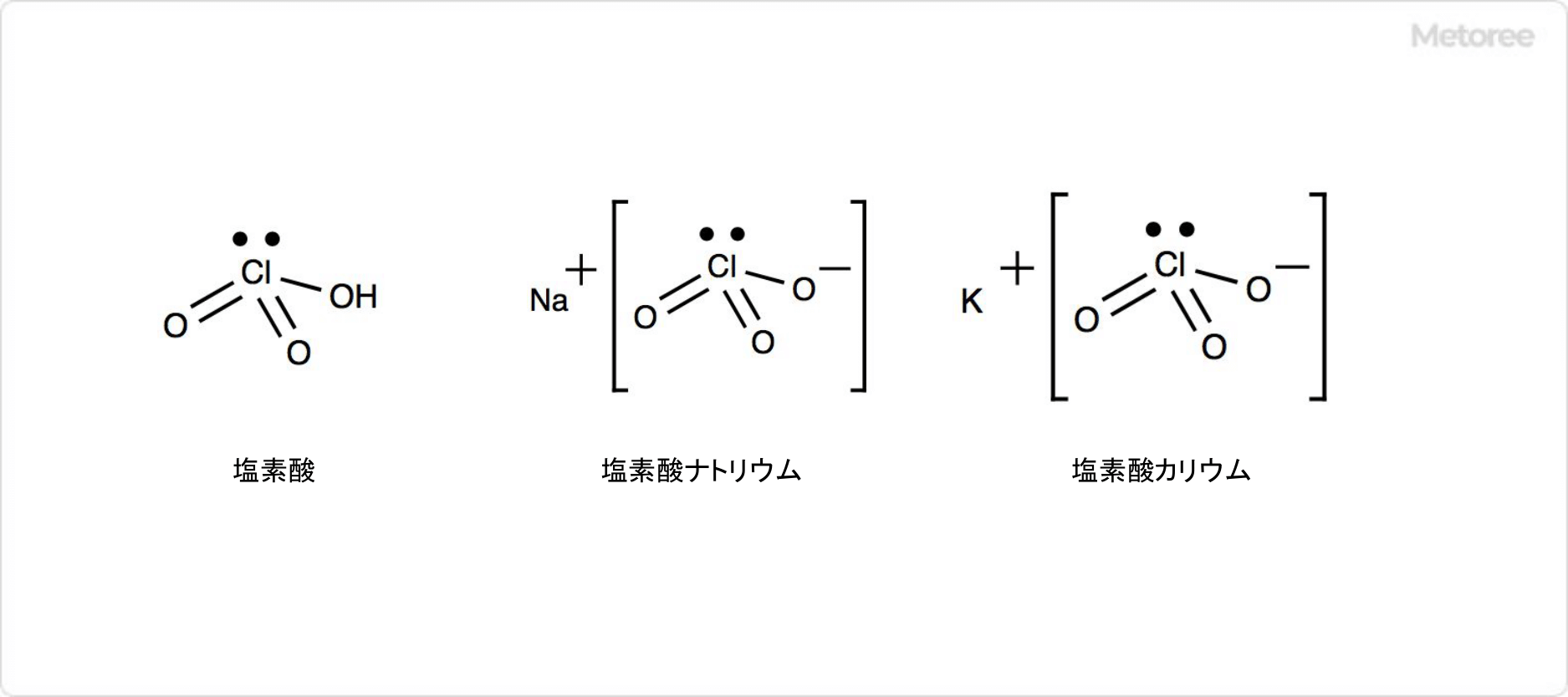
図2. 塩素酸塩の構造
塩素酸ナトリウムは、ナトリウムと塩素酸 (英: chloric acid) の塩です。塩素酸とは、塩素のオキソ酸の1種であり、化学式はHClO3です。
塩素酸の塩には塩素酸ナトリウム以外にも、塩素酸カリウム (英: potassium chlorate) などがよく知られています。塩素酸カリウムの化学式はKClO3です。
3. 塩素酸ナトリウムの関連化合物
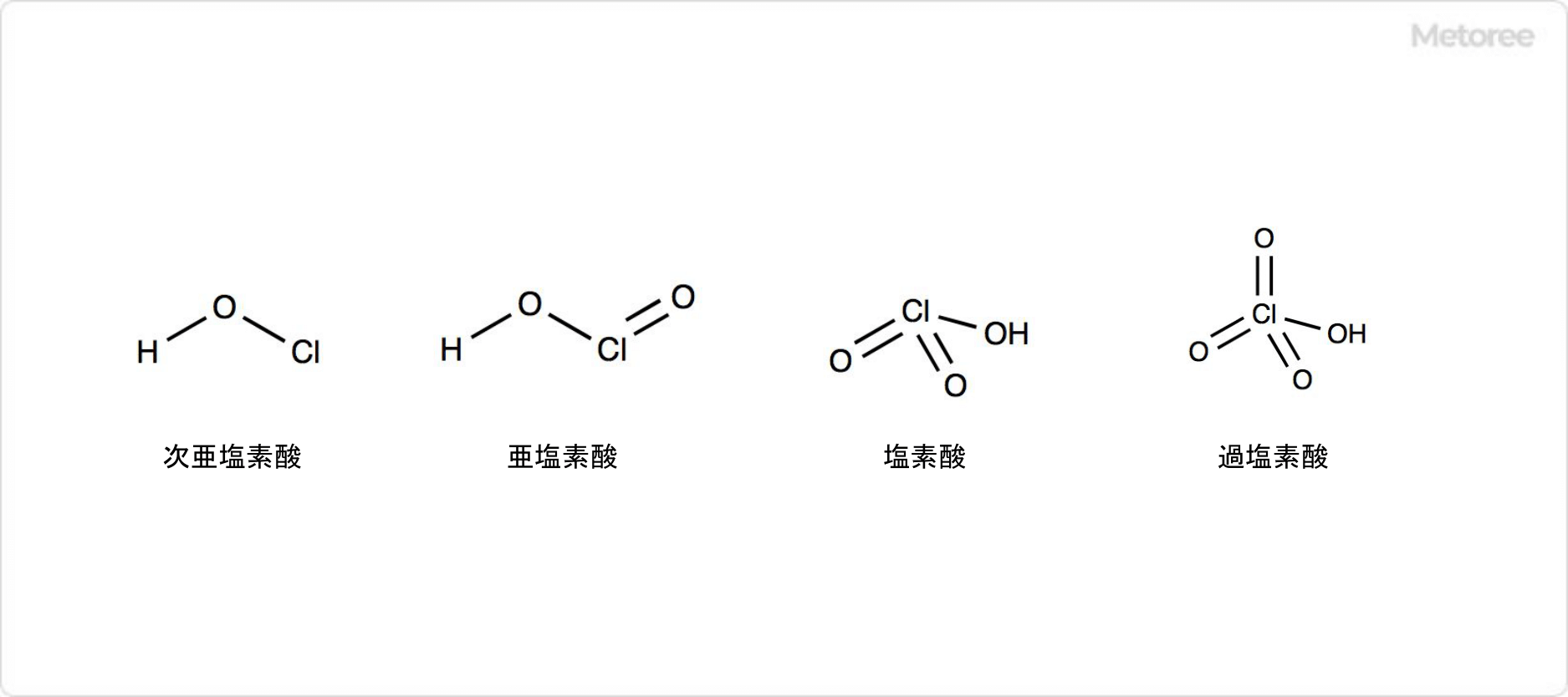
図3. 塩素酸ナトリウムの関連化合物の構造
塩素のオキソ酸には塩素酸以外にも、次亜塩素酸、亜塩素酸、過塩素酸があります。そのため、塩素酸塩だけでなく、次亜塩素酸塩や亜塩素酸塩、過塩素酸塩が存在します。
次亜塩素酸の化学式はHClOであり、塩素の酸化数は+1です。酸素原子に水素原子と塩素原子が結合した構造を取っています。亜塩素酸の化学式はHClO2であり、塩素の酸化数は+3です。
塩素原子がヒドロキシ基と酸素原子が1つずつ持っています。過塩素酸の化学式はHClO4であり、塩素の酸化数は+7です。1個のヒドロキシ基と3個のオキソ基が塩素原子に結びついた構造を取っています。

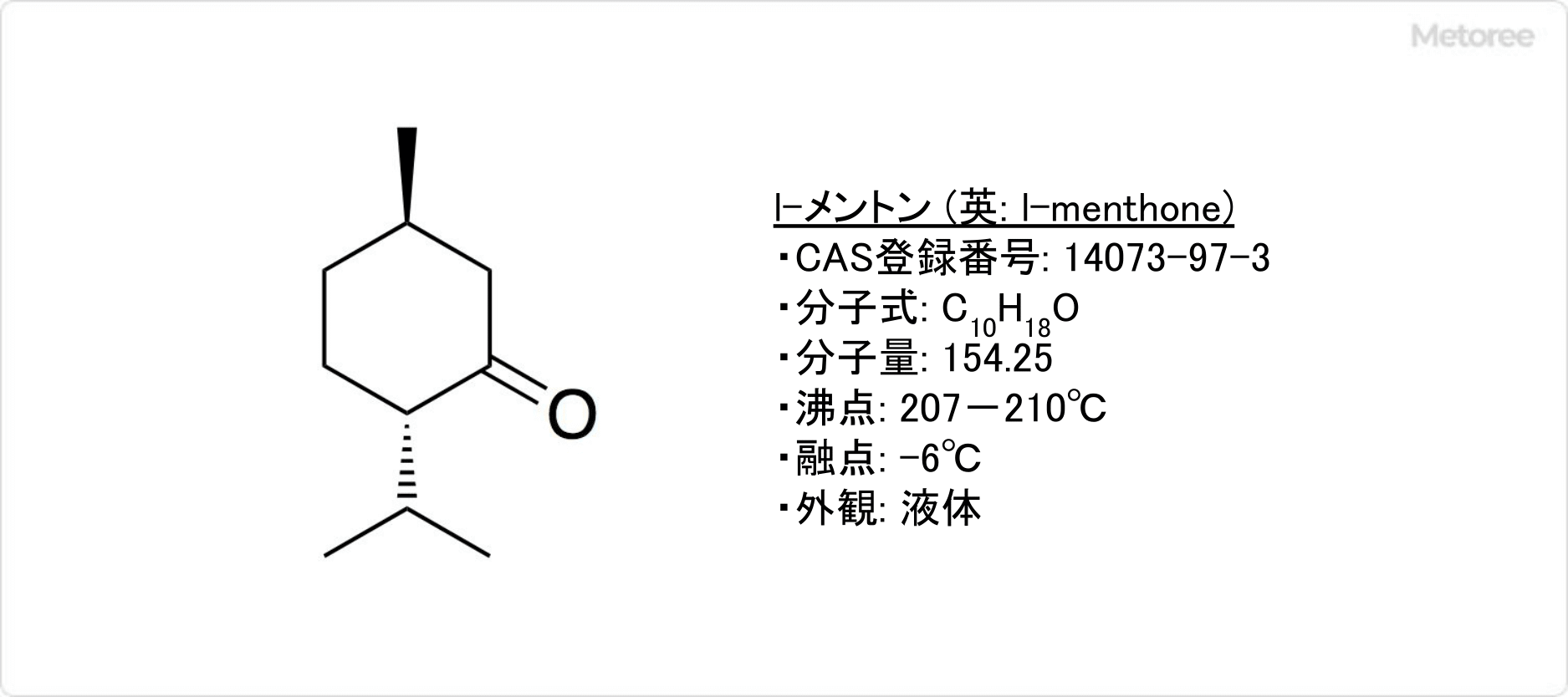
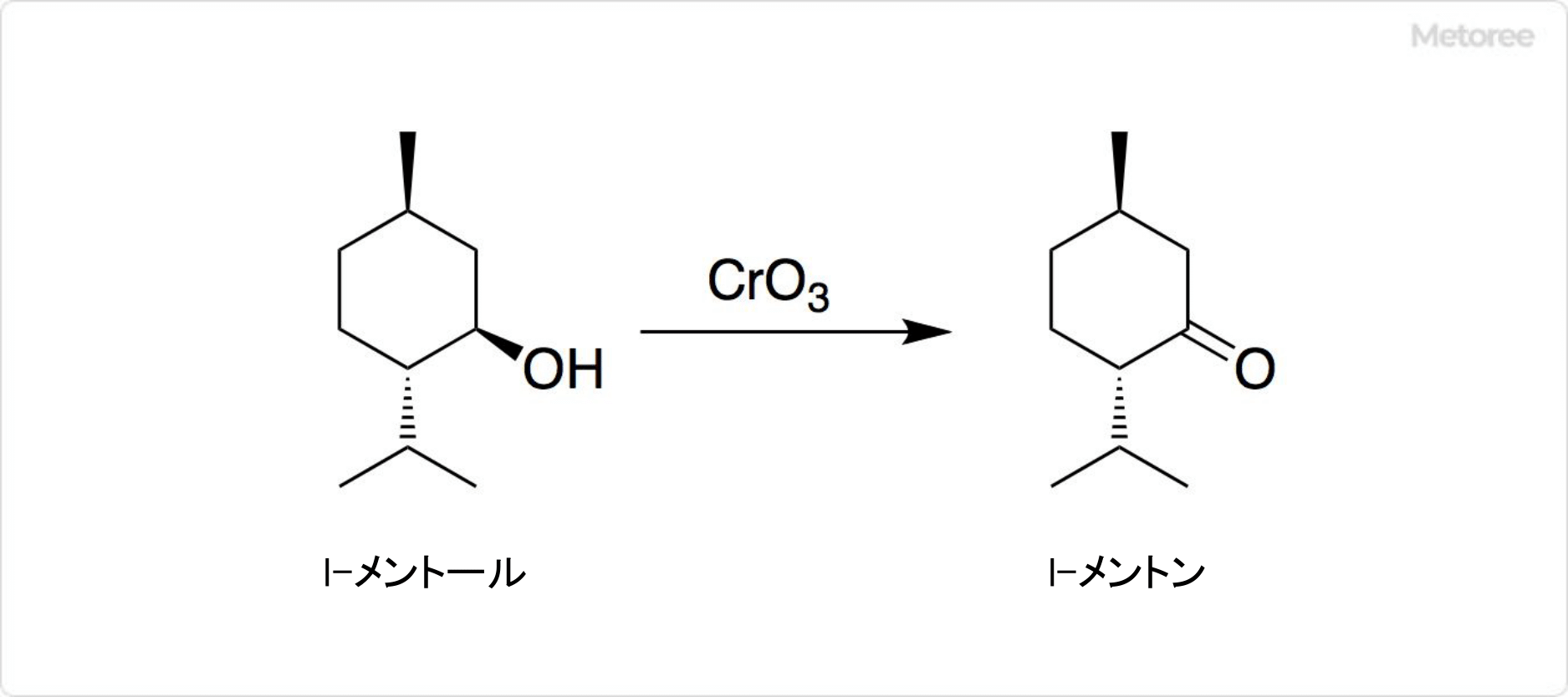
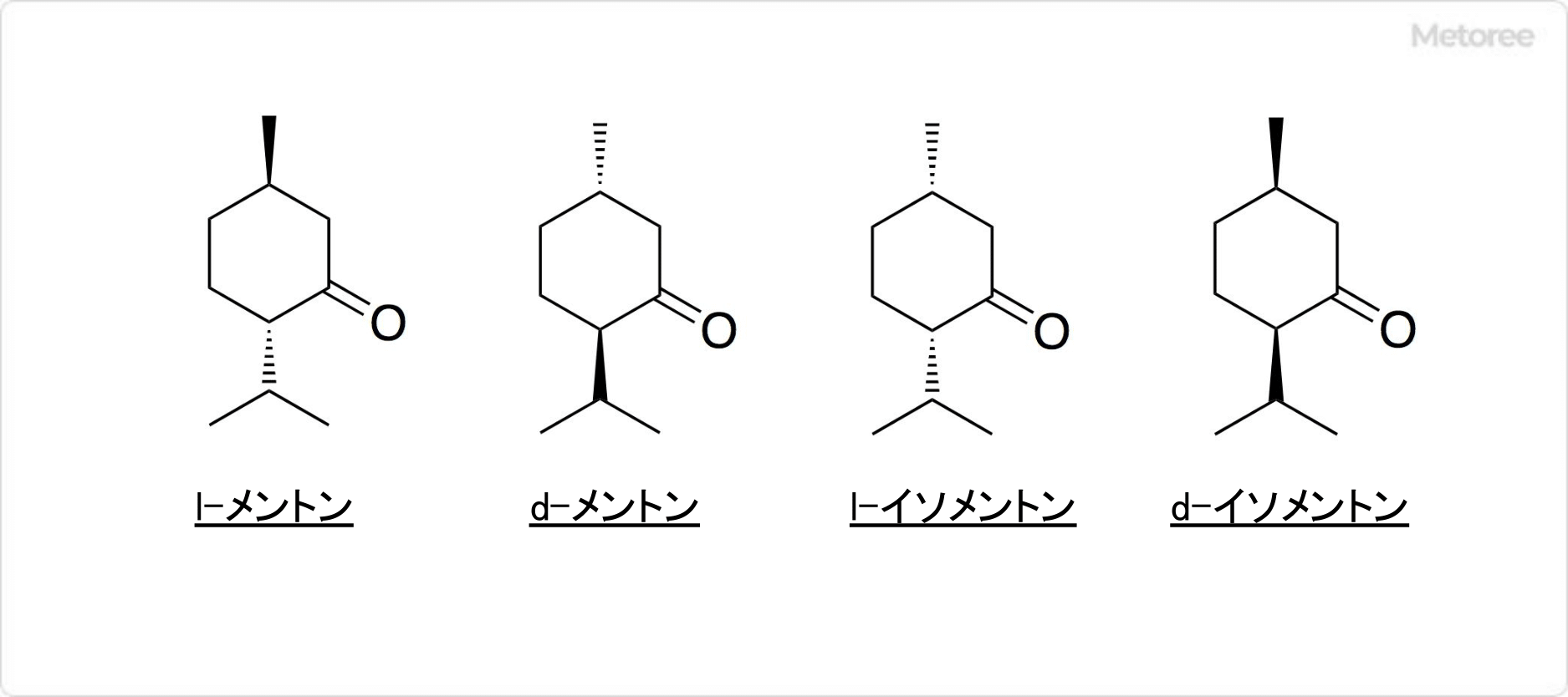

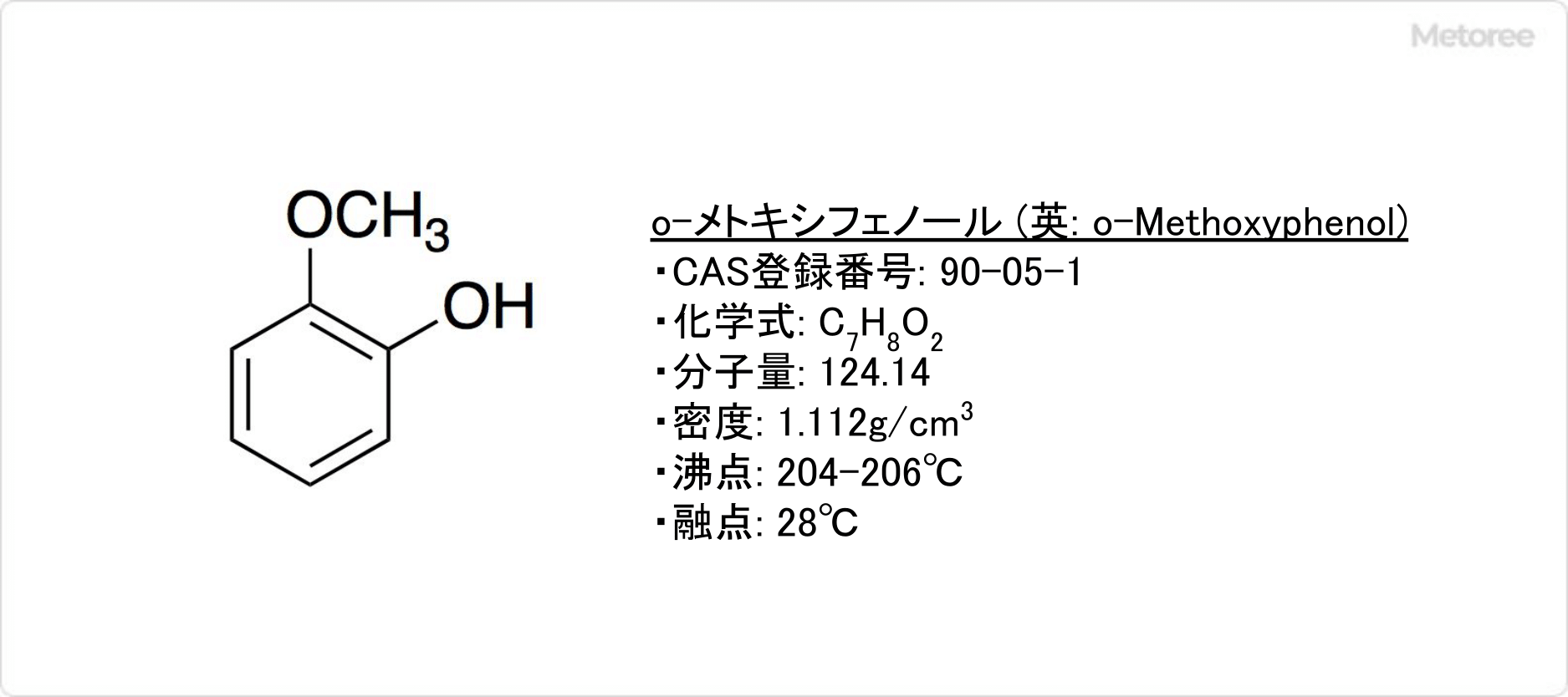
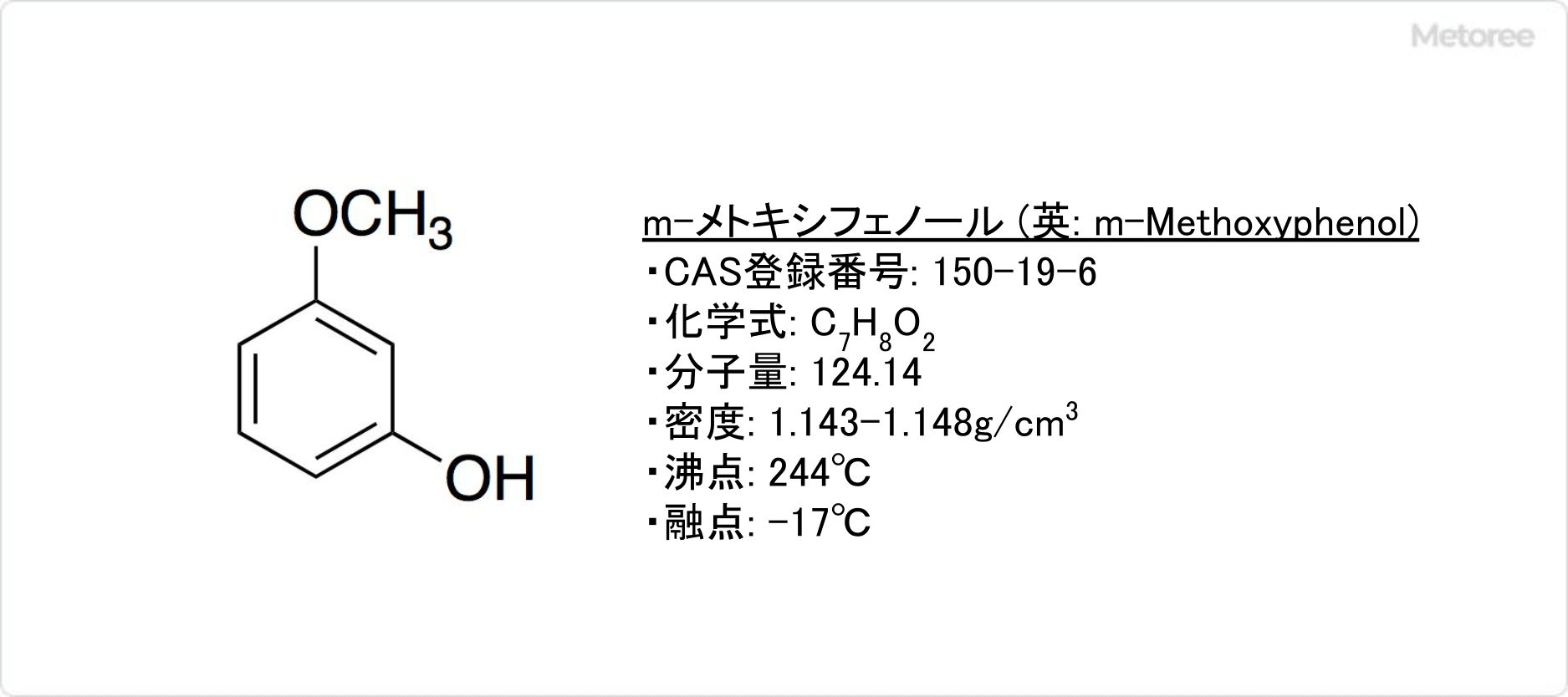
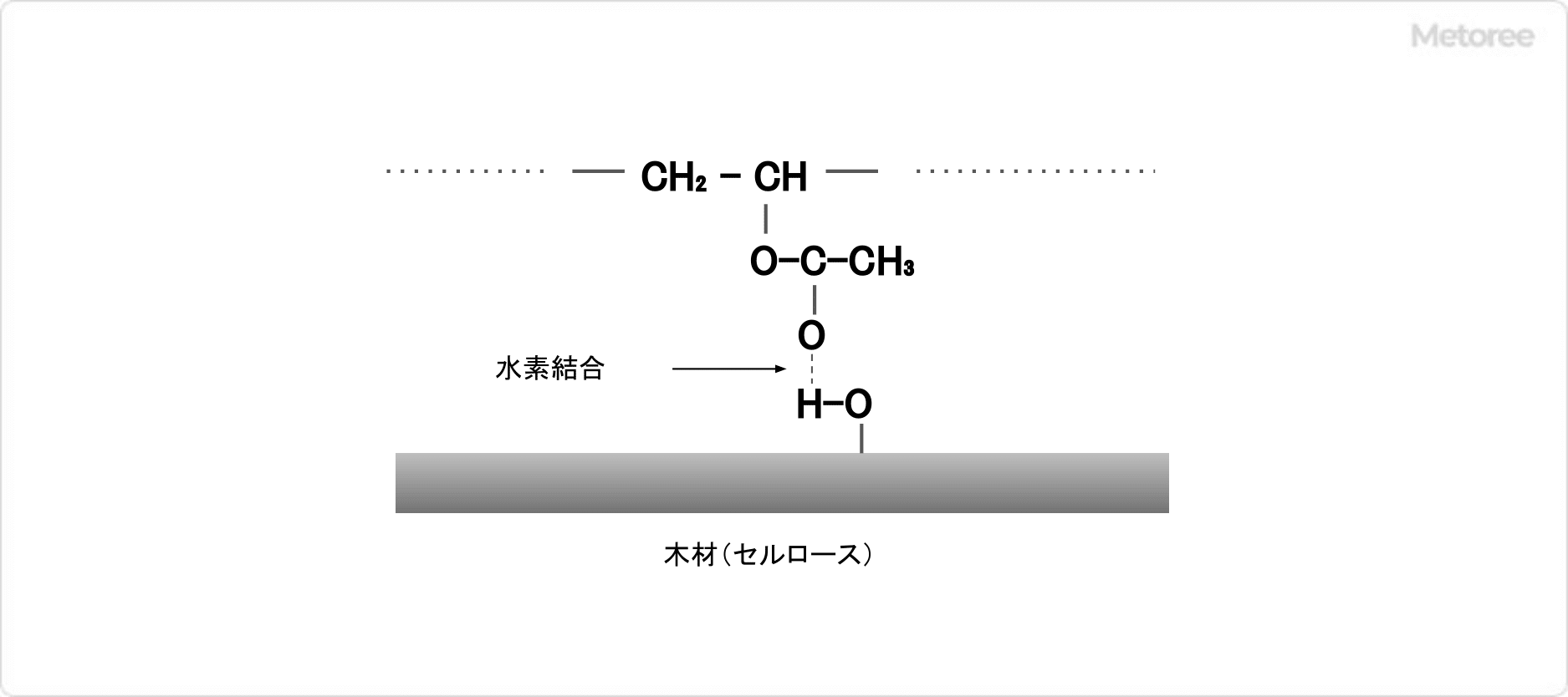 図1.ポリ酢酸ビニルと木材の接着
図1.ポリ酢酸ビニルと木材の接着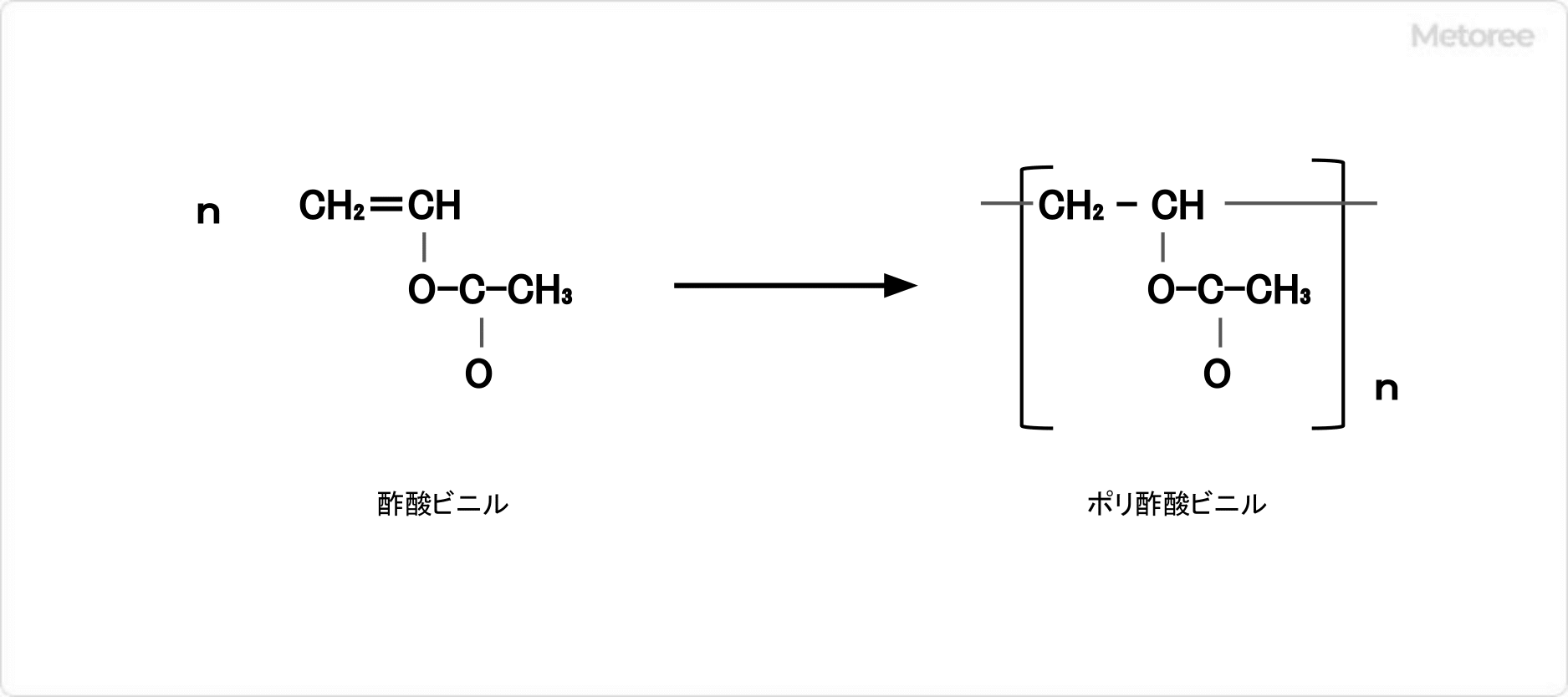 図2.ポリ酢酸ビニルの製造
図2.ポリ酢酸ビニルの製造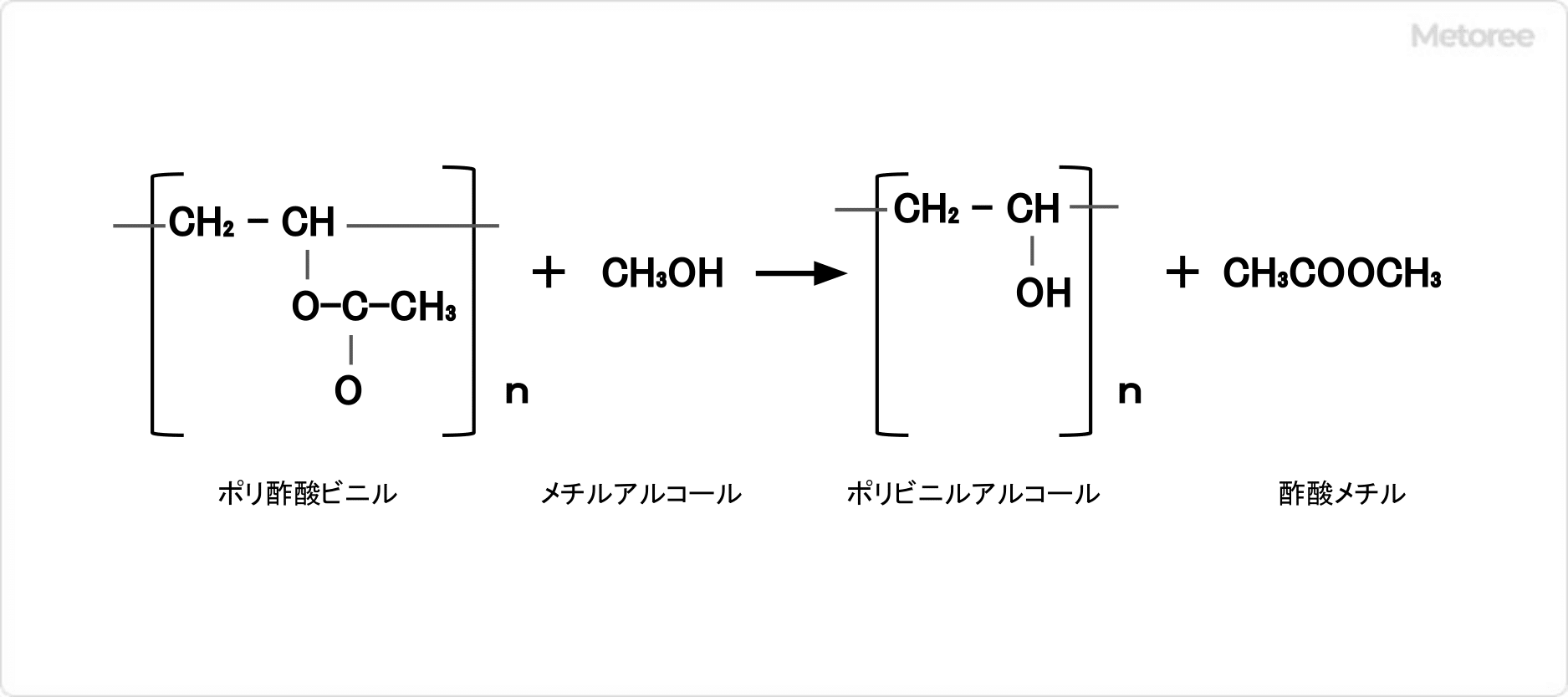 図3.ポリビニルアルコールの製造
図3.ポリビニルアルコールの製造