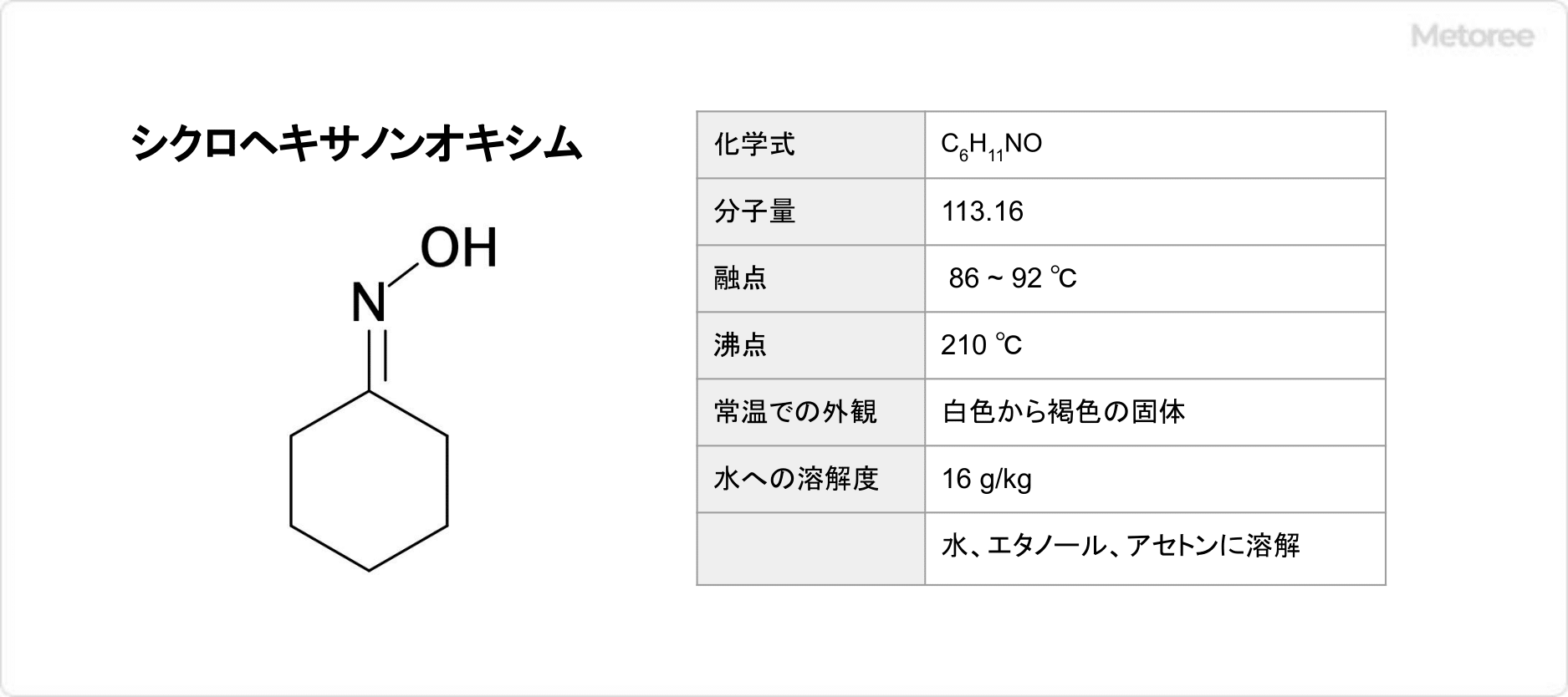
シクロヘキシミドとは
シクロヘキシミド (英: Cycloheximide) とは、無色〜淡褐色結晶の抗生物質です。
IUPAC名は4-[(2R)-2-[(1S,3S,5S)-3,5-dimethyl-2-oxocyclohexyl]-2-hydroxyethyl]piperidine-2,6-dioneです。別名として、アクチジオン (英: Actidione) 、ナラマイシンA (英: Naramycin A) 、U-4527とも呼ばれます。
シクロヘキシミドの使用用途
1. タンパク質合成阻害剤
シクロヘキシミドは、真核生物細胞におけるタンパク質合成を阻害する目的で、生化学研究分野において広く用いられています。ただし、その毒性の強さから、一般には試験管内の実験飲みに使われ、臨床では使用されていません。
リボソームに結合する2つのtRNA分子とmRNAの移動を防ぐことにより、タンパク質の翻訳を阻害します。シクロヘキシミドの作用は迅速で、培地から取り除くことで効果を除去できる便利な薬剤です。
また、ミトコンドリアのタンパク質合成は、シクロヘキシミドによる阻害に抵抗性があります。したがって、ミトコンドリアで翻訳されるタンパク質と細胞質で翻訳されるタンパク質を区別するためにも用いられていました。
2. 農薬・殺鼠剤
シクロヘキシミドは、エチレン産生を刺激するため植物の成長調節剤や、殺鼠剤などの動物用駆除剤として使用されます。また、ビール発酵における不要な細菌を検出するための培地にも有用です。
農業分野では、抗真菌剤としても使用されていました。しかしながら、DNA損傷や催奇性をはじめとする生殖への影響などの強い毒性を有することから、シクロヘキシミドの使用が減少しています。現在は、ネギべと病、カラマツ先枯病などの限られた植物病にのみ使用されている状況です。
シクロヘキシミドの性質
化学式はC15H23NO4で表され、分子量は281.35です。CAS番号は66-81-9で登録されています。融点は115〜116 °Cで、常温で固体です。
エタノールなどの有機溶媒に溶けやすく、水には2 °Cで2.1g/100mlほど溶けます。シクロヘキシミドはアルカリ条件に弱く、pH7の水溶液中で1時間煮沸することで分解します。pH2の場合、1時間の煮沸では分解しません。
シクロヘキシミドのその他情報
1. シクロヘキシミドの製造法
天然では、放射菌の1種であるストレプトマイシン生産菌 (英: Streptomyces griseus) により作られています。工業的にシクロヘキシミドは、発酵によるストレプトマイシン製造時に副産物として得られます。
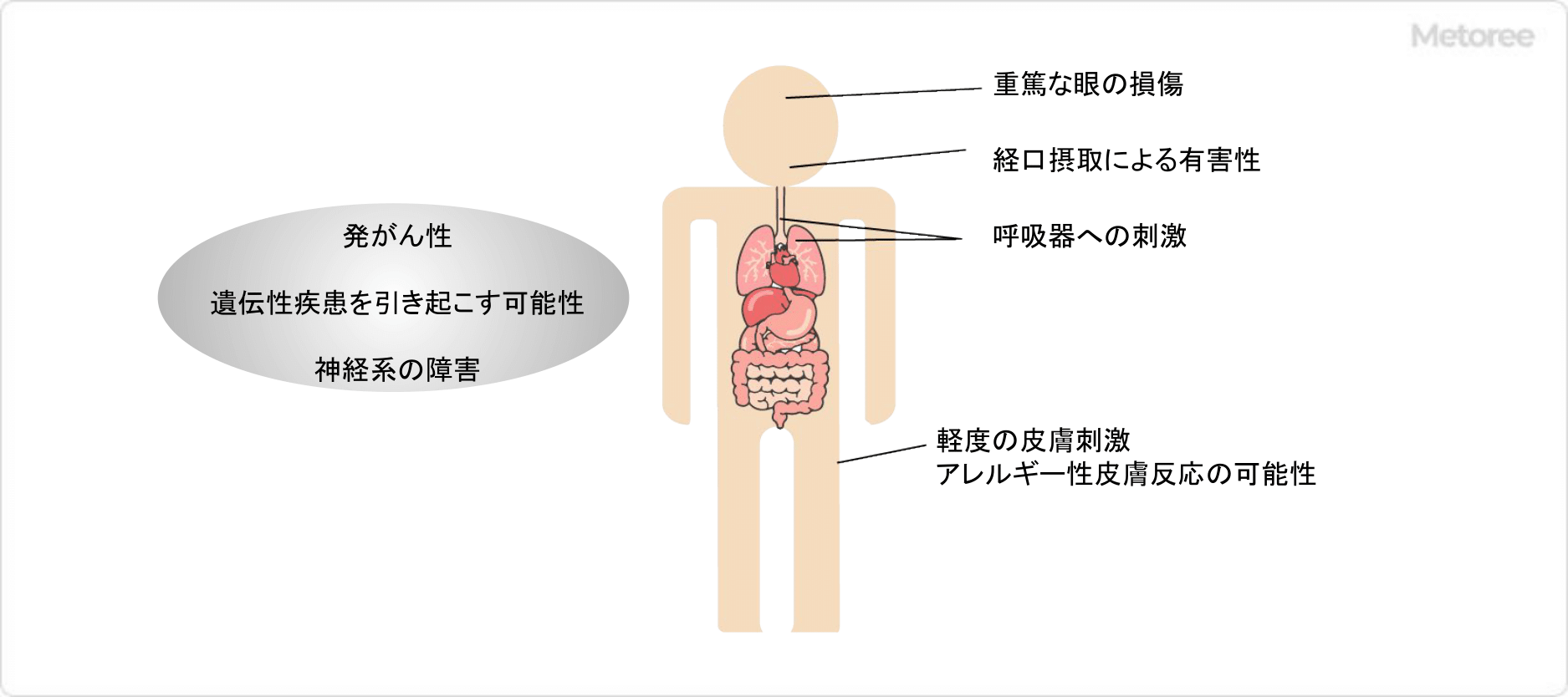
2. シクロヘキシミドの法規情報
シクロヘキシミドは、以下の国内法令に指定されています。
- 毒物及び劇物取締法
劇物 (法第2条別表第2) (法令番号:2-27) 包装等級1 - 労働安全衛生法 (令和6年の施行)
名称等を表示すべき危険物及び有害物 (法57条、施行令第18条)
名称等を通知すべき危険物及び有害物 (法第57条の2、施行令第18条の2別表第9) - 危険物船舶運送及び貯蔵規則
毒物類・毒物 (危規則第3条危険物告示別表第1) - 船舶安全法
毒物類・毒物 - 航空法
毒物類・毒物 (施行規則第194条危険物告示別表第1) - 港則法
毒物類・毒物
3. 取り扱い及び保管上の注意
取り扱い時の対策
強酸化剤は、シクロヘキシミドの混触禁止物質に当たります。取り扱い時や保管時に、近くに置かないようにしてください。取り扱い時は、局所排気装置の中で使用します。
火災の場合
シクロヘキシミドは、燃焼により一酸化炭素 (CO) や二酸化炭素 (CO2) 、窒素酸化物 (NOx) などの危険有害な分解物を生成することがあります。水噴霧、泡消火剤、粉末消火剤、炭酸ガス、乾燥砂を用いて消火してください。棒状放水は消火に用いてはいけません。
保管する場合
シクロヘキシミドは、光により変質するおそれがあります。保管する際は、遮光性のガラス容器に入れて密閉します。直射日光の当たらない、換気がよく、かつ涼しい場所に施錠して保管してください。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/66-81-9.html
https://labchem-wako.fujifilm.com/sds/W01W0103-2099JGHEJP.pdf
https://pubchem.ncbi.nlm.nih.gov/compound/Cycloheximide