グリセオフルビンとは
グリセオフルビン (英: Griseofulvin) とは、白色の結晶性粉末です。
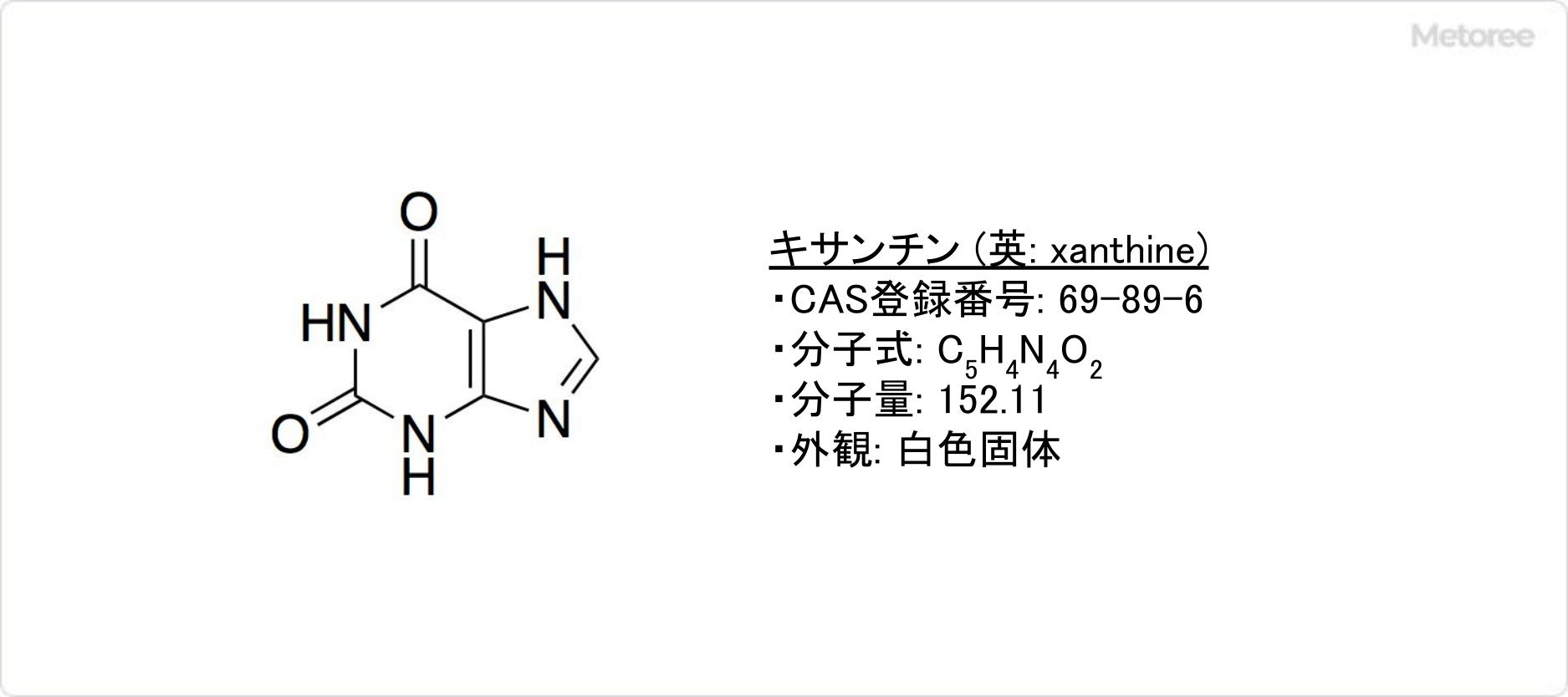
グリセオフルビンの化学式はC17H17ClO6で表され、分子量352.77、CAS登録番号は126-07-8の芳香族化合物の一種です。グリセオフルビンのIUPAC名は、(2S,6′R)-7-chloro-2′,4,6-trimethoxy-6′-methyl-3H,4′H-spiro[1-benzofuran-2,1′-cyclohex[2]ene]-3,4′-dioneです。
グリセオフルビンは、1939年にロンドン大学のオックスフォードらにより、ペニシリウム・グリセオフルバム (英: Penicillium griseofulvum) と呼ばれる土壌真菌の一種から発見されました。その後、1946年にブライアンらにより分離、1947年にグローブらによって同定されました。
グリセオフルビンの使用用途
グリセオフルビンは、抗真菌薬として使用されています。
グリセオフルビンの作用機序としては、グリセオフルビンが真菌の細胞骨格に作用して、細胞分裂を阻害することで、真菌の増殖を防ぐことによります。
グリセオフルビンは、日本でかつて経口薬として使用されてきました。しかし、頭痛やめまいなどの副作用が生じること、薬価が低いこと、また他の抗真菌薬が発売されたことなどが理由で、現在はグリセオフルビンは、日本国内では製造販売されていません。
グリセオフルビンの性質
グリセオフルビンの融点は218~222℃で、沸点は570℃、密度は1.4g/cm3です。グリセオフルビンは、エタノール、アセトン、ベンゼンに溶けにくく、水にも溶けません。グリセオフルビンは、Penicillium griseofulvumの菌体やその培養液からクロロホルムで抽出することが出来ます。
グリセオフルビンと同様の抗真菌薬としての効果を示す新薬にはテルビナフィンがあり、グリセオフルビンに比べ短期間で効果を発揮することが知られています。一方で、一部の頭皮感染症に対してはテルビナフィンよりも優れた効果を示すこともあります。
グリセオフルビンを服用した時の副作用としては、アレルギー反応、吐き気、下痢、頭痛、睡眠障害、倦怠感などがあります。肝不全やポルフィリン症の人には推奨されません。妊娠中または妊娠前の数か月に服用すると、産まれてくる赤ちゃんに害を与える可能性があります。
グリセオフルビンのその他情報
1. グリセオフルビンの製造法
グリセオフルビンは、真菌ペニシリウム・グリセオフルバムを発酵させることによって、工業的に得られます。グリセオフルビンの生合成では、6炭素ポリβ-ケト鎖の合成に始まり、クライゼン縮合、アルドール縮合、環化芳香族化などを経てベンゾフェノン中間体を形成します。さらに、メチル化、ハロゲン化、フェノール酸化の後、ラジカルカップリングにより生成したテトラヒドロフラノン種をO-メチル化し、オレフィンの立体選択的還元することで、グリセオフルビンが得られます。
2. 法規情報
グリセオフルビンは、消防法、労働安全衛生法、労働基準法、毒物および劇物取締法などの主要な国内の法規制において、いずれも非該当です。ただし、化学物質排出把握管理促進法 (PRTR法) においては、「新規指定化学物質 (第2種)」に指定されているため、注意が必要です。
3. 取扱いおよび保管上の注意
取扱い及び保管上の注意は、下記の通りです。
- 容器を密栓し、乾燥した冷暗所に保管する。
- 屋外や換気の良い区域のみで使用する。
- 使用時は保護手袋、保護眼鏡、保護衣、保護面を着用する。
- 粉塵を吸い込まないよう、充分注意する。吸入などして気分が悪い時は、医師の診断、手当てを受ける。
- 取扱い後はよく手を洗浄する。
- 皮膚に付着した場合は、速やかに水で洗い流す。
- 眼に入った場合は、水で数分間注意深く洗う。