フルオレンとは
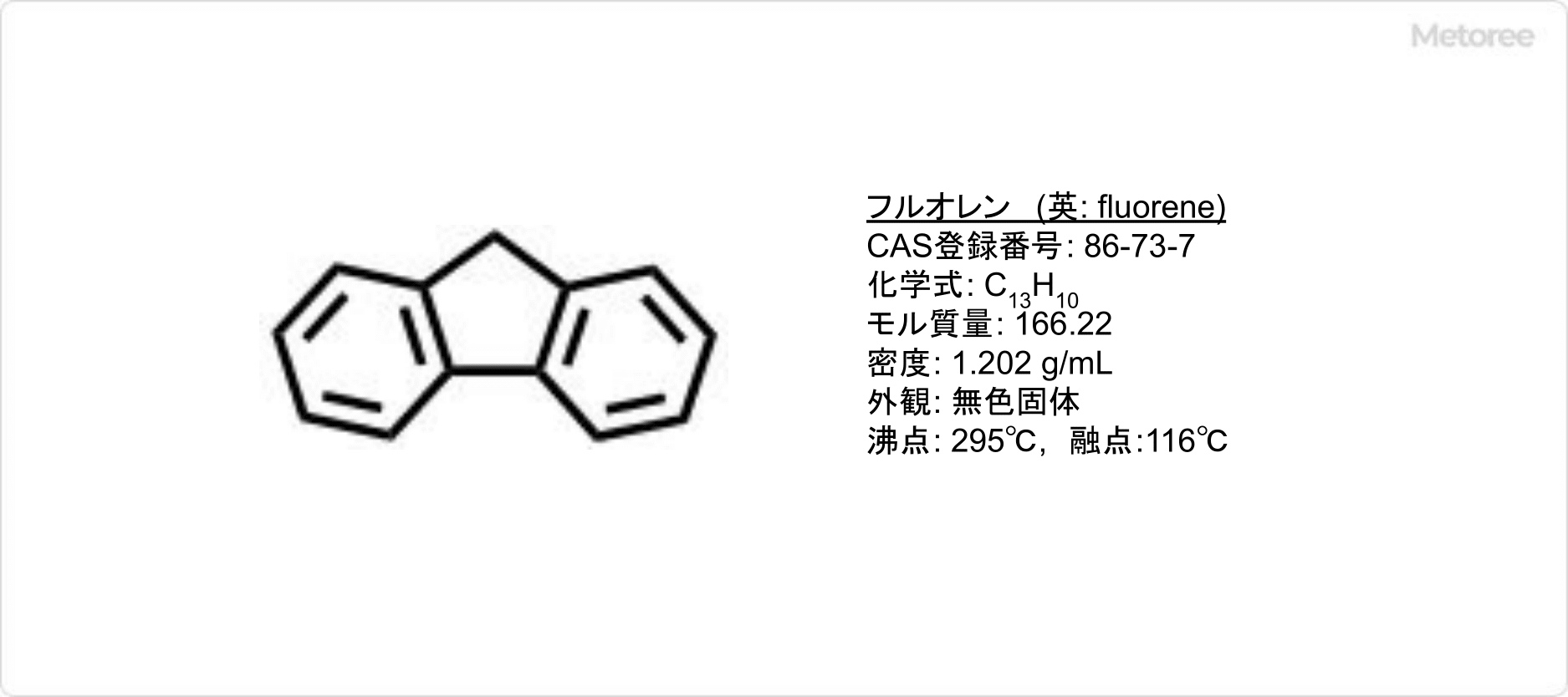
フルオレンとは、芳香族炭化水素の一つで、光沢がある無色の板状結晶です。
コールタールの蒸留により分離して得られ、水に溶けませんが、エーテル・ベンゼン等に溶けるといった性質をもちます。通常、不純物を含むフルオレンは、蛍光を発する性質があります。特に、アルコール溶液は、弱い紫色の蛍光を発することが特徴です。
また、酸化することでフルオレノンが得られます。フルオレノンは染料製造の中間体として用いられ、化学構造において9位のメチレン基は反応性が高いことが特徴です。メチレン基は塩基の存在下で、アルデヒドやカルボン酸エステルと反応し、エチリデン誘導体やケトン誘導体を生成します。
フルオレンの使用用途
フルオレンは各種薬品合成の原料となる他、有機ELデバイス (有機電子デバイス) において、発光層や電荷輸送層として使用されます。またフルオレノンの製造原料として使用されています。
フルオレノンは、「電子写真感光体」「機能性樹脂」「有機中間体」などの原料として利用されている化合物です。各種誘導体は、「感光体」「光機能材料」「機能性樹脂」「有機中間体」「有機EL」といった分野で注目されています。
樹脂に導入することで、高屈折率と低複屈折が両立できる効果や、耐熱性を高める効果など、類を見ない樹脂特性が得られます。そのため、「液晶ディスプレイ」「携帯用カメラレンズ」「半導体関連材料」などとして幅広く使用されています。
蛍光色素や染料の原料としても使われ、特に緑色から黄色の蛍光を発するフルオレセインという染料は、生化学的分析などで広く使われています。またフタル酸や酢酸エステル、アミンなどの芳香族化合物の合成に利用されるなど有機合成反応の試薬としても使用されます。その他、燃料添加剤としても使われることも知られており、燃料中の硫黄化合物を除去する効果から、環境保護のための燃料添加剤として利用されます。
フルオレンの性質
フルオレンは無色透明の固体で、融点は116〜118℃、沸点は295℃、密度は1.17 g/cm3 (20℃) です。水に対する溶解度は0.005 g/100mLで、健康被害の報告はないものの吸入すると呼吸器刺激、頭痛、めまいなどの症状が現れることがあります。
1. 物理的性質
無色透明の結晶性固体であり、芳香性があります。水には溶けにくく、アルコールやベンゼン、トルエンなどの有機溶媒には良く溶けます。水との界面活性は低く、界面活性剤としてはあまり適していません。
2. 化学的性質
フルオレンは芳香族炭化水素であり、ベンゼン環に比べて反応性が高く、有機合成反応に利用されます。フルオレンは芳香族性を持ち、ベンゼン環同士がπ結合で結合しているため、共役系を持ちます。光によって励起されると、独自の蛍光を発します。そのため、蛍光染料の原料や発光材料として利用されます。
化学的に安定で、光や空気に対しても安定しており、強い芳香性と独特の香りがあります。高い融点と沸点を持ち、熱にも強く、有機溶媒には溶解する性質を持っており、光を吸収する性質があることから、発光性があるとされています。
フルオレンのその他情報
1. フルオレンの合成
フルオレンの合成法は多く存在しますが、代表的なものは下記の通りです。
ディールス・アルダー反応
ディールス・アルダー反応は、ジエンとエノンが反応してシクロヘキサジエンを生成する反応です。この反応を用いることで、シクロヘキサジエンを開環することでフルオレンを得ることができます。
フリーデル・クラフツ反応
フリーデル・クラフツ反応は、芳香族化合物の合成に広く用いられています。この反応を用いることで、ベンゼン環にアルミニウム塩化物などのルイス酸を用いてアシル化した後、脱水素反応によってフルオレンを得ることができます。
シクロアディション
シクロアディションは、二重結合を持つ化合物同士が反応して環状化合物を生成する反応です。この反応を用いることで、フルオレンの前駆体であるジフェニルブテンを生成し、さらに酸化反応を行うことでフルオレンを得ることができます。
熱分解
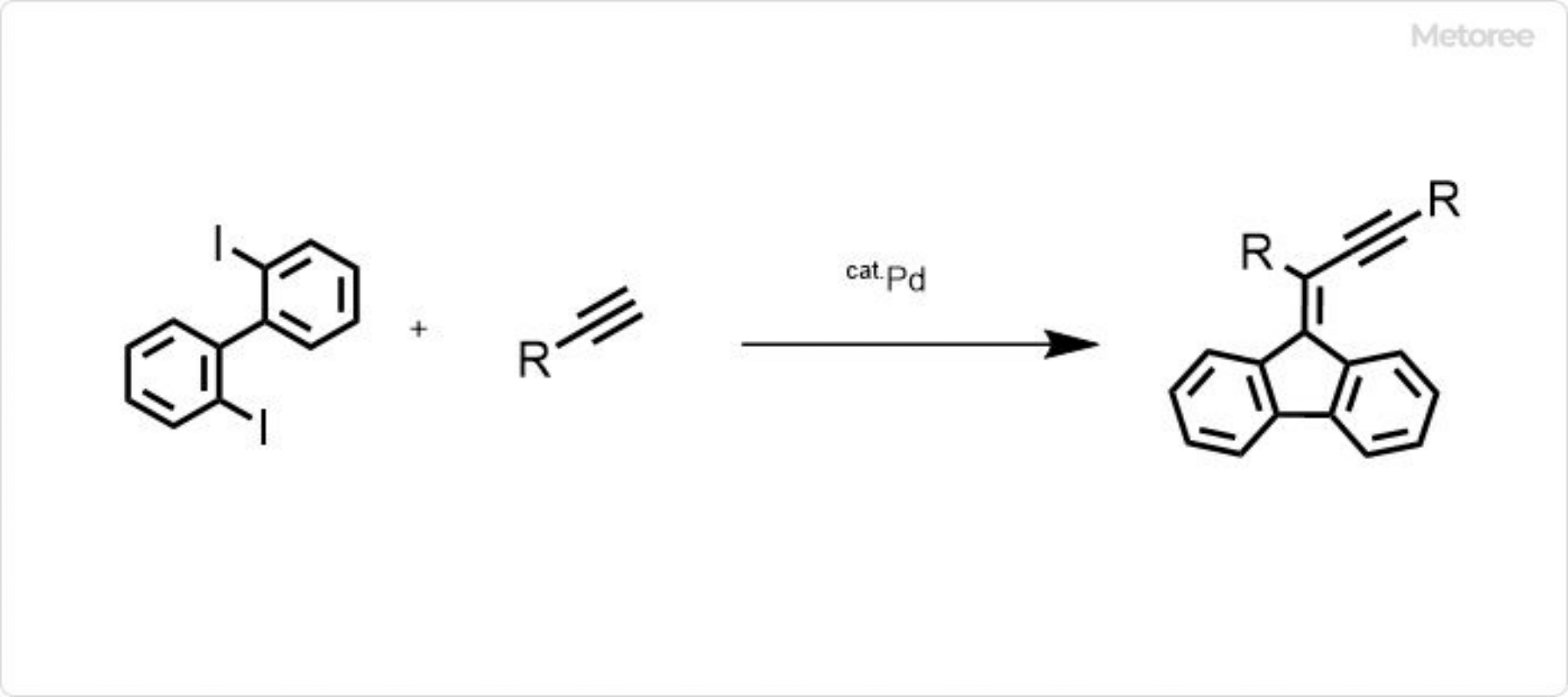
図2. ジハロビフェニルを原料としたフルオレンの合成
芳香族炭化水素を高温で熱分解することでフルオレンを生成することができます。この方法は比較的簡単で、フルオレンを大量に合成することができますが、生成物に不純物が多く含まれることがあるため、精製が必要となります。
またジヨードビフェニル等のジハロビフェニルを原料としたパラジウム触媒存在下でのクロスカップリング反応によってフルオレン誘導体が合成できます。
2. フルオレン誘導体合成の反応機構
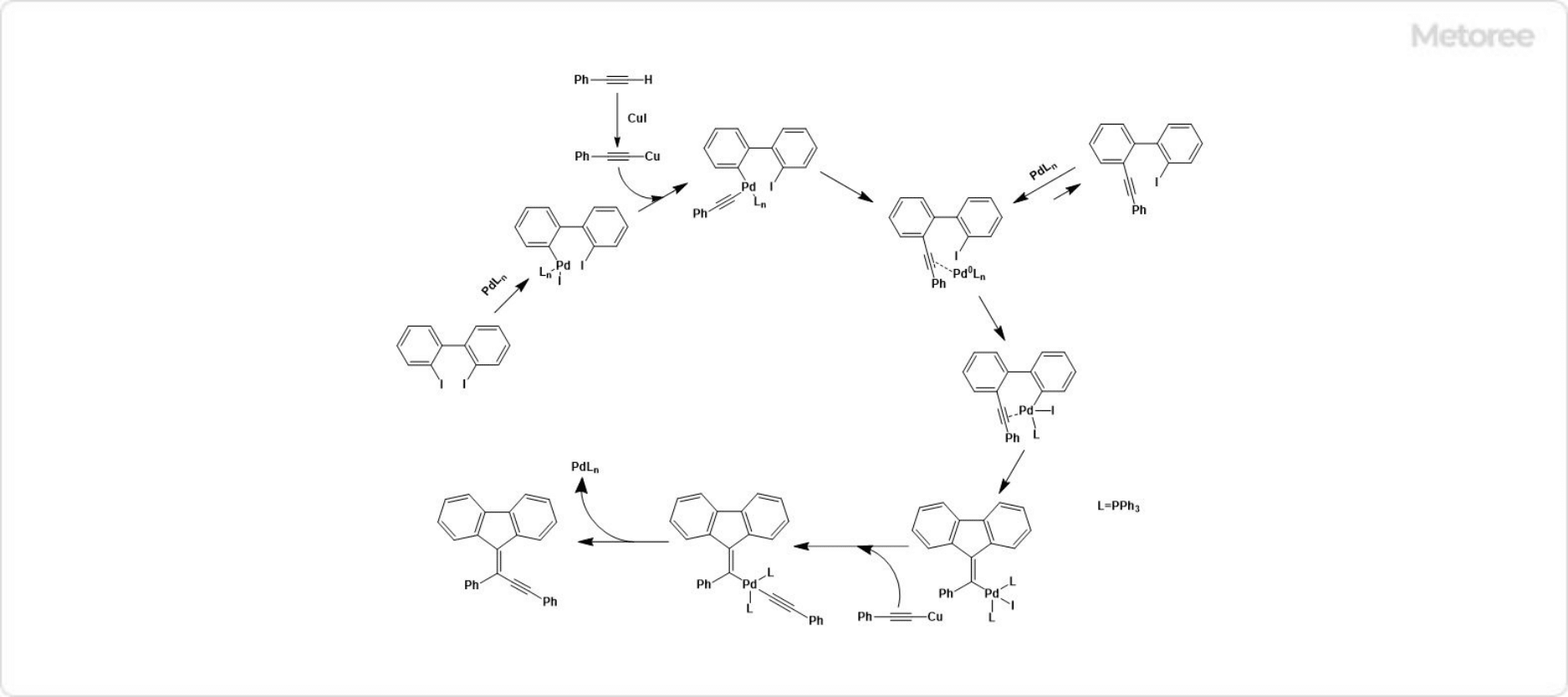
図3. フルオレン誘導体のクロスカップリング・環化反応機構
フルオレン誘導体は以下に示す反応機構によって形成されます。
0価のPdが酸化され2価のPdへと変化しながら付加する酸化的付加が起こり、銅アセチリドとの金属交換反応でアセチレンが結合した後、2価のPdが0価へと還元されながら脱離する還元的脱離するクロスカップリング反応を2回繰り返すことで環化反応が進行します。