硫化カリウムとは
硫化カリウム (英: Potassium sulfide) とは、カリウムの硫化物であり、通常組成式K2Sで表される一硫化カリウムです。
CAS登録番号は1312-73-8です。また、多硫化カリウムとしては、二、三、四、五硫化カリウムがありますが、こちらは通常ポリ硫化カリウムと称されます。水和物には、二水和物、五水和物、十二水和物があります。
硫化カリウムの使用用途
硫化カリウムの主な用途は、医薬、医薬中間体、脱毛剤、分析試薬などです。入浴剤、銅板めっきの材料をはじめ、肥料、染色、還元剤、農薬、皮膚病薬などにも用いられます。分析試薬や医薬品の中間原料としては、硫化物イオンの供給源として用いられる物質です。
また、硫化カリウムは、花火の原料ではないものの花火の発色に寄与します。花火の黒色火薬が燃焼中に硫化カリウムを生成し、炎色反応により華やかさを演出します。
さらに、硫黄ナノ粒子を合成する場合において、硫化カリウムは硫黄源としての用途もあります。硫化カリウムの水和物は、多種ありますが、水溶解度が大きく、二次電気を化学的に貯蔵できる装置として高エネルギー密度の電池への応用が可能です。
硫化カリウムの性質

図1. 硫化カリウムの基本情報
硫化カリウムは、分子量110.262、融点840℃であり、常温での外観は白色の結晶です。
ただし、吸湿したものは赤色または茶色を帯びます。特徴的な臭気があり、密度は1.805g/mLです。水に易溶であり、アルコールやグリセリンにも可溶ですが、エーテルには溶解しません。 発火性、爆発性、潮解性があります。
硫化カリウムの種類
硫化カリウムは、主に研究開発用試薬製品や工業用薬品として販売されています。研究開発用試薬製品としては、25gや500gの容量単位で販売されており、実験室で取り扱いやすい容量での提供が一般的です。
通常、室温で保管可能な試薬製品として取り扱われます。工業用薬品としては、液体 (溶液) でも提供されている物質です。液体の場合は35%以上などの濃度が一般的であり、7.5kgや15kgなどの単位で提供されています。液体の硫化カリウムは、染料としての用途が一般的です。
硫化カリウムのその他情報
1. 硫化カリウムの合成
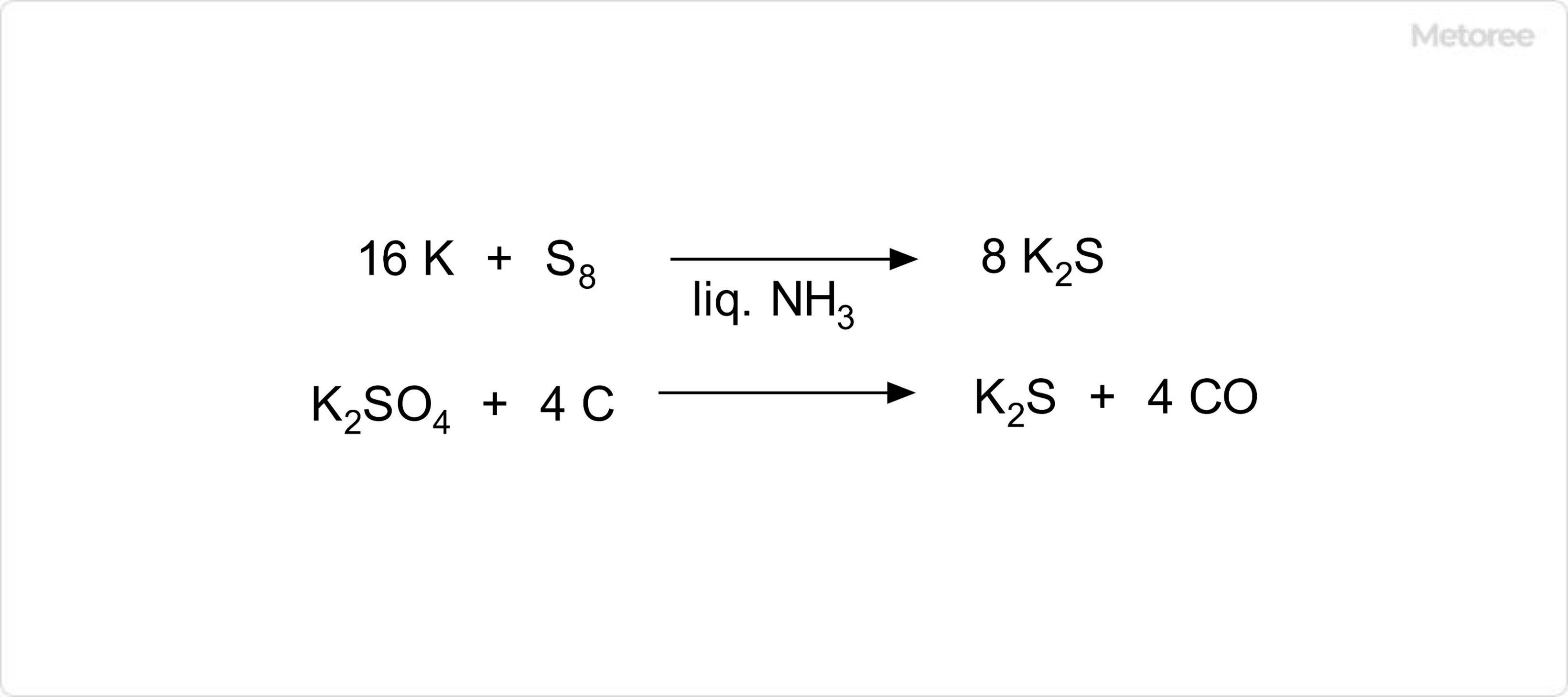
図2. 硫化カリウムの合成
硫化カリウムの実験室的製法では、無水液体アンモニア中でカリウムと硫黄とを反応させる方法が一般的です。また、工業的には、硫酸カリウムを炭素 (石炭) を反応させる方法によっても合成が可能です。
2. 硫化カリウムの化学反応
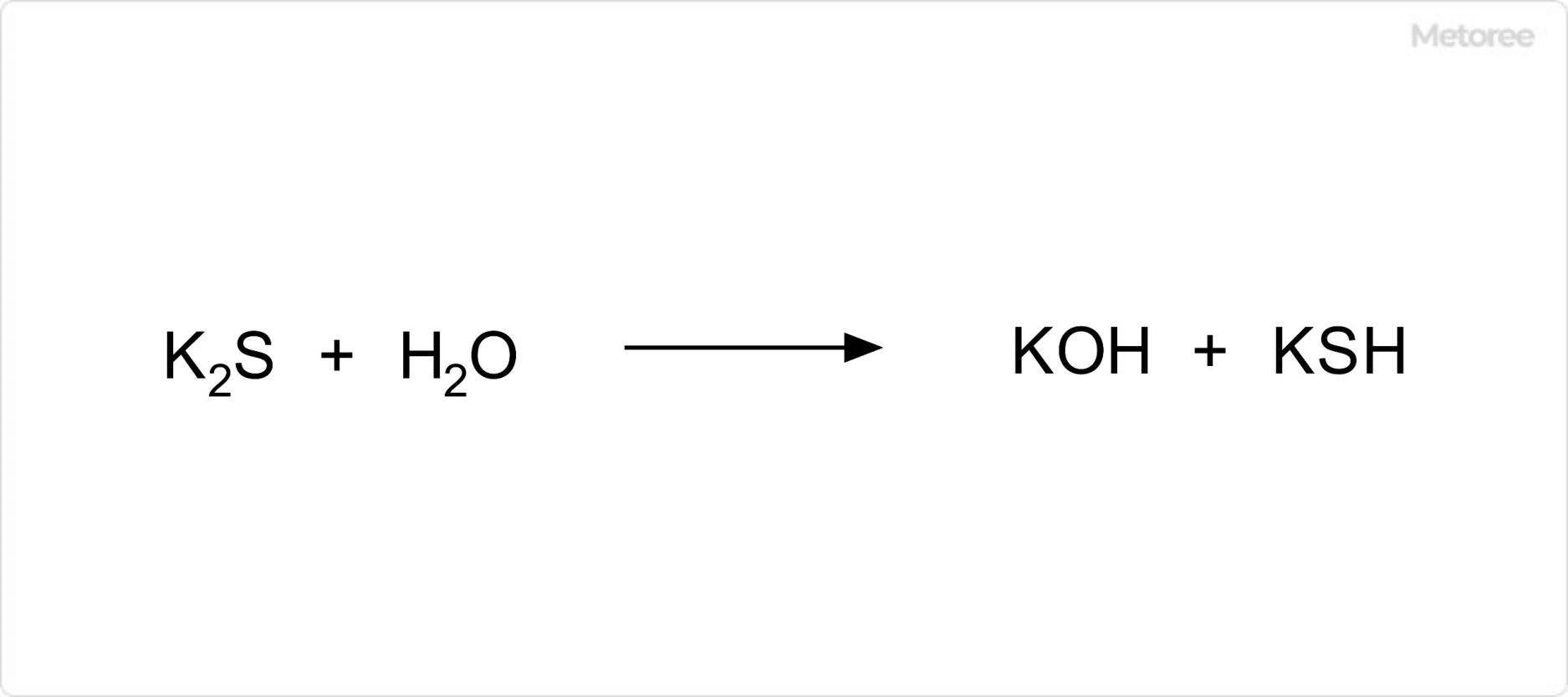
図3. 硫化カリウムの加水分解
硫化カリウムは、強い還元性、腐食性を持つアルカリ性物質です。引火しやすく、空気に触れると自然発火する可能性があり、燃焼の際は硫化水素や硫黄酸化物などの有毒ガスが発生します。また、空気中の酸素や炭酸ガスと徐々に反応して硫化水素が発生します。
硫化カリウムは、加水分解によって水酸化カリウムと硫化水素カリウムに分解されます。このため、水溶液は強いアルカリ性です。また、酸との接触では分解して硫化水素が発生する他、酸化剤との接触では二酸化硫黄が生じます。
3. 水和物
硫化カリウムの五水和物は、硫化水素カリウムの水溶液に水酸化カリウムの水溶液を加えて濃縮することで得ることができます。また、硫化カリウムの五水和物を水素気流中で加熱することで硫化カリウムの無水物を得ることが可能です。
4. 硫化カリウムの危険性
硫化カリウムは、前述の通り、自己発熱及び発火のおそれがある物質です。吸い込むと呼吸器系の障害を起こす危険性があり、具体的には肺水腫を起こす危険性があり、飲み込むと生命に危険を及ぼします。その他では、重篤な皮膚の薬傷や眼の損傷の危険があります。適切な保護手袋、衣類及び保護眼鏡、保護面などの保護具を着用し、安全に取り扱うことが大切です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/cas-1312-73-8.html