硫化カルシウムとは
硫化カルシウム (英: Calcium sulfide) とは、組成式CaSで表されるカルシウムの硫化物です。
CAS登録番号は、20548-54-3です。常温常圧では無色固体の形状を取ります。通常、「硫化カルシウム」という名称は単硫化物を指しますが、その他には四硫化物、五硫化物が存在します。
硫化カルシウムの使用用途
硫化カルシウムの主な使用用途は、潤滑油の添加物、電子エミッターの材料、塗料、ニス、食物保存剤などです。また、脱毛作用を利用して皮のなめしに使われます。処分場での埋め立て材にも使われており、石膏製ギプスのリサイクルや石炭製品の処理過程などでも用いられている物質です。
電子エミッターの材料としては、特に純度の高い硫化カルシウムに希土類元素を加えて、エレクトロルミネッセンス材料として使用する用途があります。また、四硫化物や五硫化物などの多硫化物は、農業用殺虫・殺菌剤への用途もあります。
硫化カルシウムの性質

図1. 硫化カルシウムの基本情報
硫化カルシウムは、分子量72.14、融点2,525℃であり、常温での外観は無色の結晶です。密度は2.8g/mLです。冷水に極めて溶けにくい性質を持ちます (溶解度: 0.015g/100mL (10°C)) 。
硫化カルシウムの構造
硫化カルシウムの結晶は立方晶系結晶です。結晶構造中では、1つの硫黄原子が八面体を形成する6つのカルシウム原子に取り囲まれた構造をしており、また、それぞれのカルシウム原子は6つの硫黄原子に取り囲まれた構造をしています。
硫化カルシウムの種類
硫化カルシウムは、一般には主に研究開発用試薬製品として販売されています。
容量の種類には10g、25g、100g、500gなどがあり、実験室で取り扱いやすい容量での提供が中心です。通常、室温で保管可能な試薬製品として取り扱われています。
硫化カルシウムのその他情報
1. 硫化カルシウムの合成
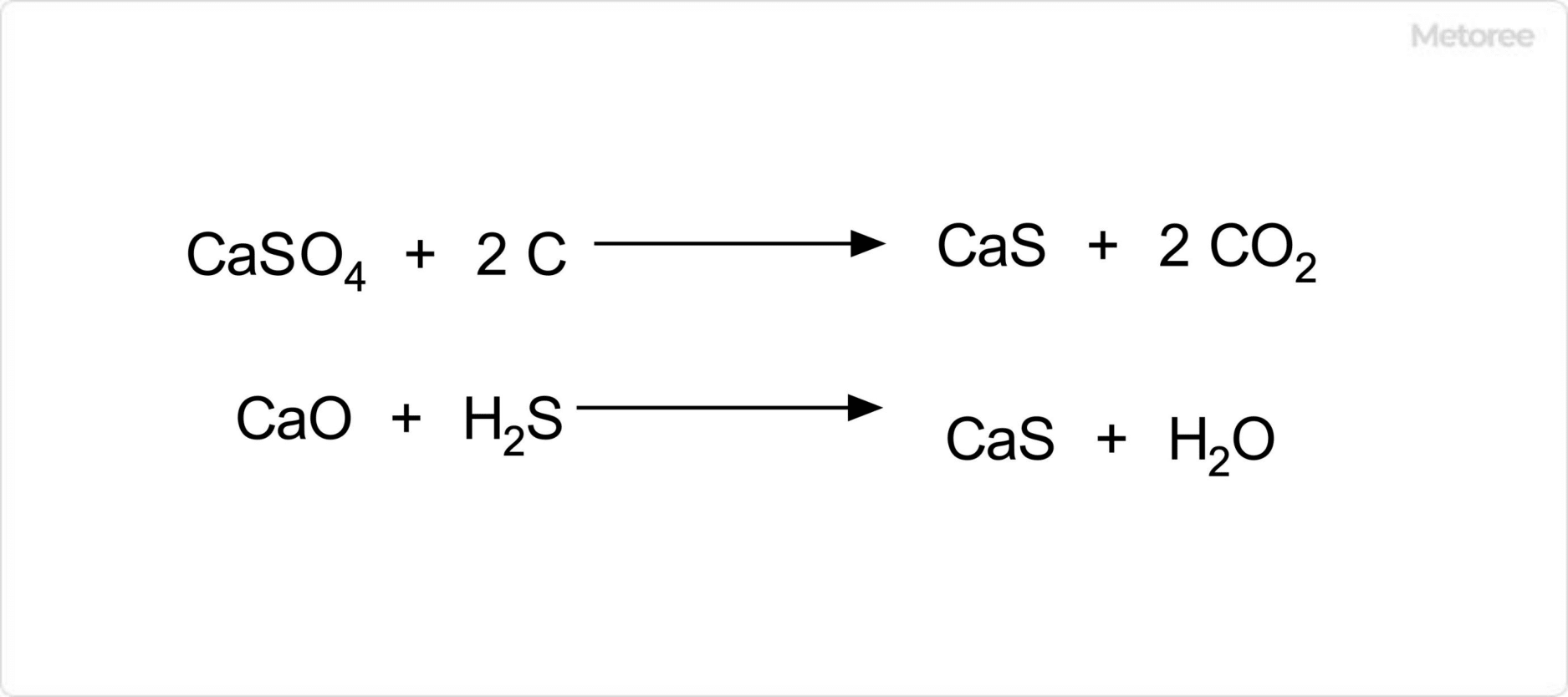
図2. 硫化カルシウムの合成
硫化カルシウムは、硫酸カルシウムと炭素を無酸素条件下で900℃に加熱することで合成が可能です。この反応は、すなわち硫酸カルシウムの炭素還元反応でもあります。
また、酸化カルシウムを赤熱するまで加熱して硫化水素を通じる方法によっても硫化カルシウムを得ることができます。
2. 硫化カルシウムの化学反応
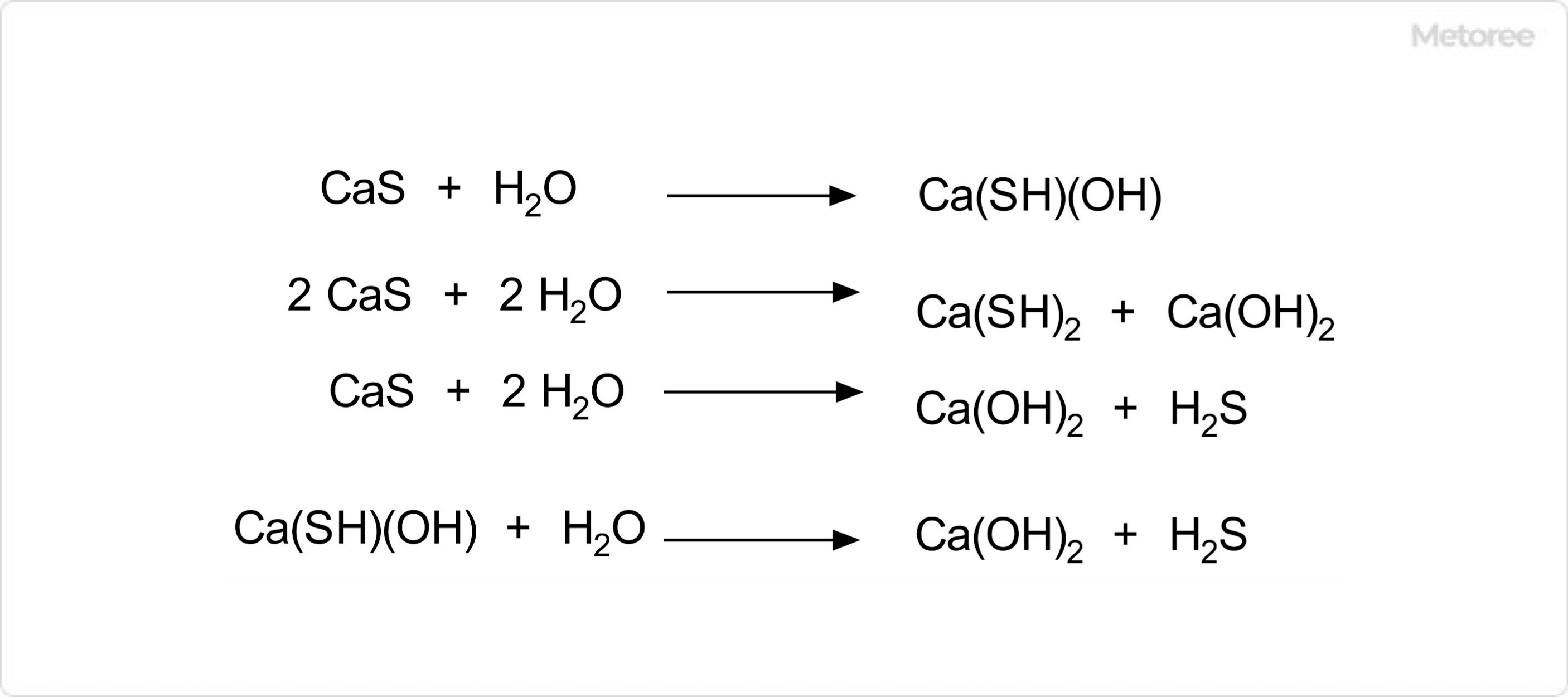
図3. 硫化カルシウムの化学反応
硫化カルシウムは、湿度が高い環境下では、空気中の水分と反応して、水硫化カルシウム Ca(SH)2、水酸化カルシウムCa(OH)2、Ca(OH)(SH)の混合物を生じます。また、この時生じるCa(SH)(OH)はさらに水と反応して水酸化カルシウムと硫化水素を生成します。
乾燥空気中では、酸化が進行することにより硫化カルシウムからチオ硫酸カルシウムが生じます。また、希酸を加えることにより簡単に分解して硫化水素を発生します。例えば、塩酸との反応では、生成物は塩化カルシウムと硫化水素です。
3. 硫化カルシウムの有害性
硫化カルシウムは、前述の通り水に触れると可燃性/引火性ガス (硫化水素) を発生します。また、人体への有害性も知られており、具体的には以下のような症状などが挙げられます。
- 皮膚刺激
- 強い眼刺激
- 呼吸器への刺激のおそれ
GHS分類においては、以下が指定されています。
- 皮膚腐食性/ 刺激性 : 区分2 (皮膚刺激)
- 眼に対する重篤な損傷性/眼刺激: 区分2 (強い眼刺激)
また、硫化カルシウムは自然界において、水生生物に非常に強い毒性を及ぼすことが知られている物質です。
4. 硫化カルシウムの保管上の注意
硫化カルシウムは加熱や酸との混触により、刺激性の有毒なガスやヒュームを生じます。大気中の水分とも徐々に反応し、硫化水素を発生することから、保管の際は密閉容器内での保管が必要です。熱、湿気を避け、また酸化剤、酸との混触を避ける必要があります。
参考文献
https://www.kojundo.co.jp/dcms_media/other/CAI04PAG.pdf