尿素とは

尿素とは、ほ乳類の尿の中に含まれている窒素化合物の1つです。
尿素は別名、ユリア、ウレア、カルバミド等とも呼ばれます。加熱すると分解して、アンモニア、シアヌル酸、ビウレットに変わります。
尿素は、カルシウムシアナミドの加水分解やカルバミン酸アンモニウムの脱水などによって合成可能です。また、ヘキサンなど多くの直鎖炭化水素やその誘導体と包接化合物を生成します。過酸化水素との包接化合物は、固体で取り扱える酸化剤として市販されています。
尿素の使用用途
尿素は、肥料やユリア樹脂 (尿素樹脂) の原料として主に利用されています。また、利尿剤や催眠剤、保湿剤、石油中のn-アルカンの抽出、ヒドラジンやメラミンの合成原料としても用いられています。
高品位の尿素水溶液は、ディーゼル車等で生成する窒素酸化物の浄化に使用可能です。これを尿素SCRシステムと言います。
尿素には、他にも医薬品類としての用途があり、角化症・乾燥性皮膚疾患治療剤 (軟膏剤) 、神経・筋機能賦活剤 (静注用) 等が挙げられます。さらに、尿素水溶液には、タンパク質の変性作用があり、タンパク質の可溶化や構造安定性の評価に用いることも可能です。
尿素の性質
尿素は加熱すると約133℃で融解し、さらに加熱すると分解してアンモニア等を生じます。エタノールには可溶ですが、エーテルには不溶です。水に溶けるとアルカリ性になり、硫酸銅を加えると紫色を呈します。
また、潮解性を持っているほか、非線形光学現象 (英: nonlinear optical phenomena) を示します。非線形光学現象とは、強い光に対し媒体の応答が比例しなくなることです。
尿素の構造

図2. ヴェーラー合成による尿素の生成
尿素は無色無臭の柱状結晶であり、モル質量は60.06g/mol、 示性式はCO(NH2)2です。初めて無機化合物から合成された有機化合物であり、有機化学史において重要な物質です。
フリードリヒ・ヴェーラー (英: Friedrich Wöhler) は、シアン酸アンモニウムの水溶液を加熱することで、尿素が合成できることを確認しました。この合成法はヴェーラー合成 (英: Wöhler synthesis) と呼ばれています。
当時の化学では生気論と呼ばれる (英: vitalism) 生物にしか有機化合物が作り出せないという考えが正当とされていました。尿素の合成は生気論を覆す内容でしたが、尿素を有機化合物と呼べるかは議論の余地があります。すなわち、尿素は炭酸のアミドに相当し、通常炭酸は有機化合物に含まれないためです。
尿素のその他情報
1. 尿素の合成法
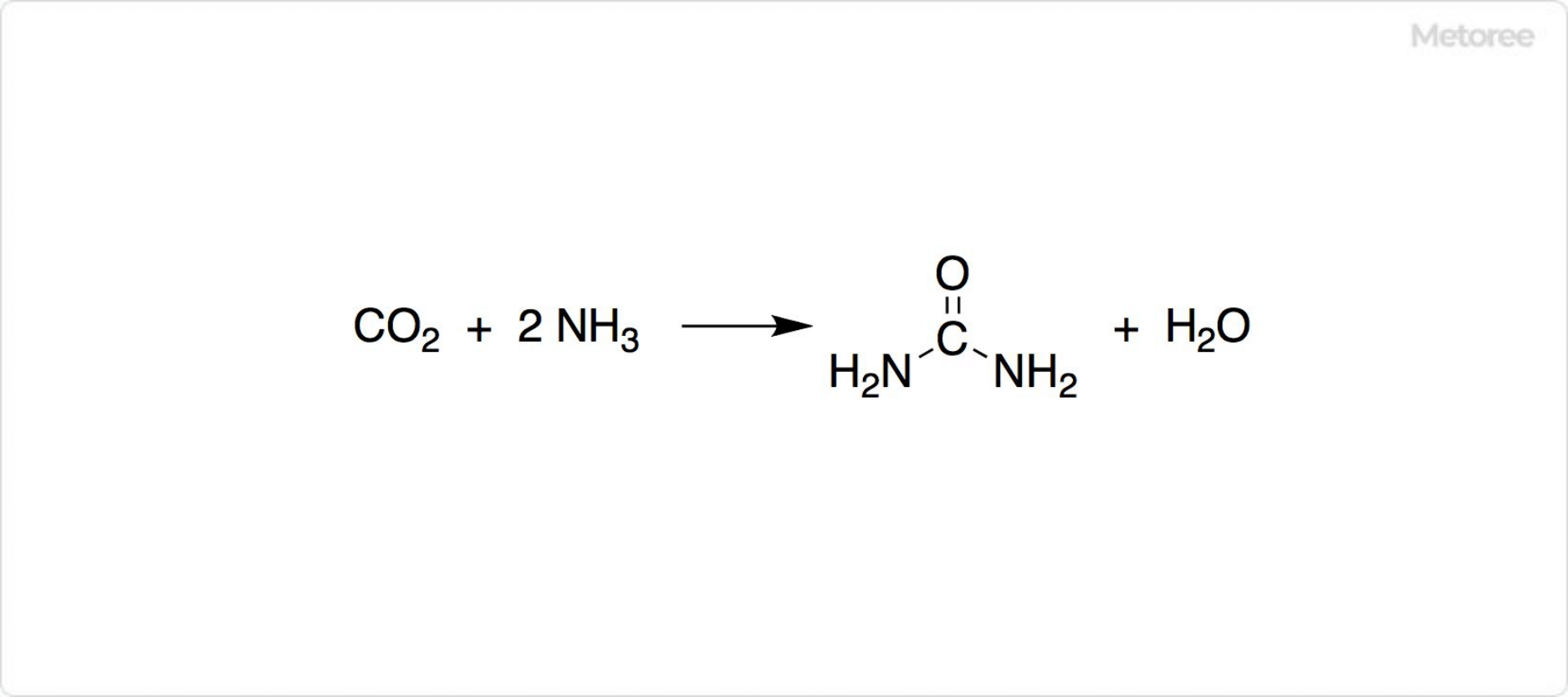
図3. 工業的な尿素の合成法
ヴェーラー合成以外にも、工業的な尿素の製法が知られています。具体的には、二酸化炭素とアンモニアを原料として、120℃、150気圧以上で尿素を合成可能です。
2. 尿素による窒素の排泄
哺乳類、軟骨魚類、両生類は尿素によって、窒素を排泄しています。ヒトの場合にも、タンパク質などによって取り入れた窒素の過剰分やアンモニアが尿素回路を通り、尿素として尿中に排泄されます。ちなみに、硬骨魚類はアンモニアによって、鳥類や爬虫類の多くは尿酸 (英: uric acid) として窒素を排泄することが可能です。
尿酸は分子式がC5H4N4O3、分子量が168の有機化合物であり、ヒトや多くの霊長類にとってはプリン代謝の酸化最終生成物でもあります。最も単純な窒素化合物はアンモニアですが、生体には有害です。そのため、安全な尿素として貯めた後に、水溶液として排泄されています。
ただし、水溶性の尿素は水とともに捨てる必要があり、濃縮にもエネルギーが必要になります。水の確保が重要な場合には、非水溶性の尿酸の方が有利です。
3. 尿素の排泄と健康
成人は30g程度の尿素を、1日で排泄しています。しかし、過剰なストレスが原因で尿酸の生産が進み、尿酸の排泄が追いつかず、結晶化して有害性を示すことがあります。これが痛風 (英: gout) です。