ヘキセナールとは
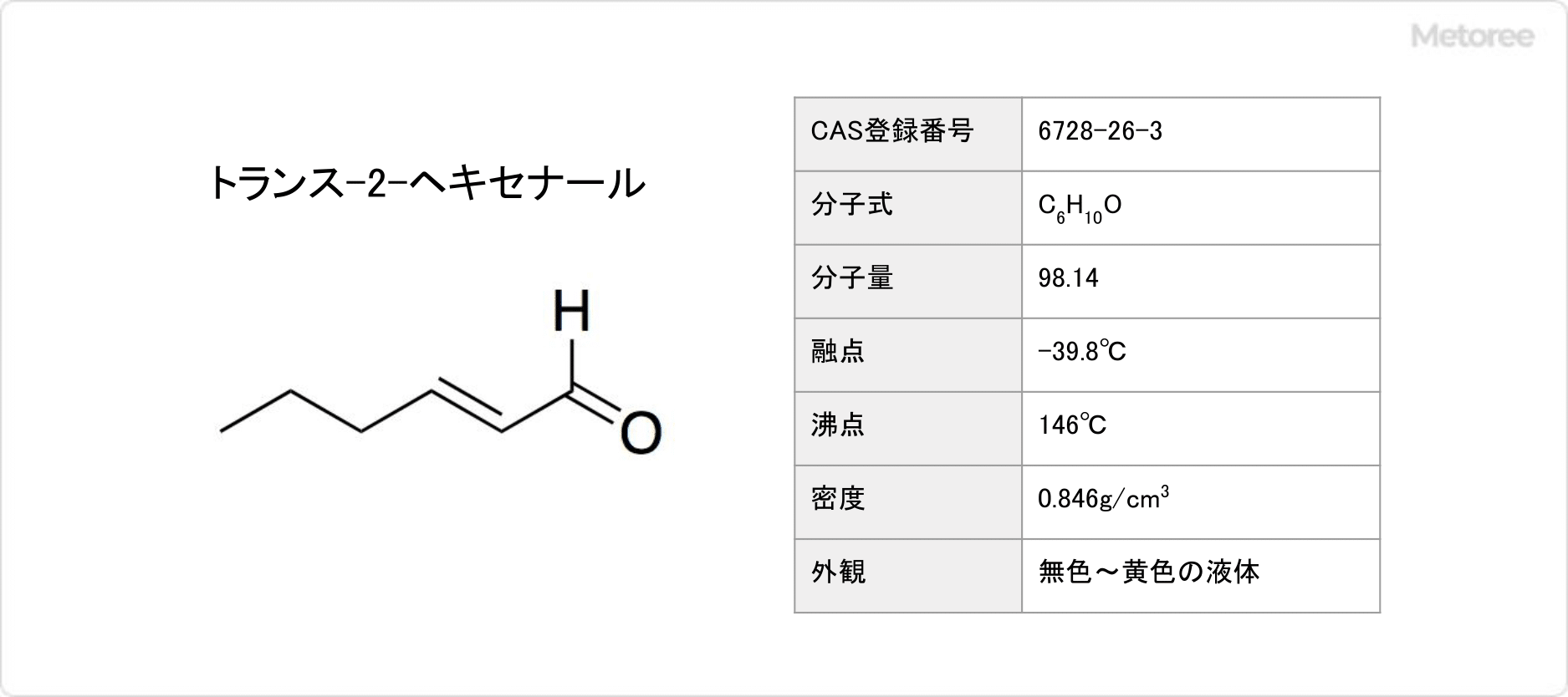
図1. トランス-2-ヘキセナールの基本情報
ヘキセナールとは、化学式がC6H10Oで表される有機化合物です。
トランス-2-ヘキセナール (英: trans-2-Hexenal) とシス-3-ヘキセナール (英: cis-3-Hexenal) を代表として、さまざまな異性体が存在します。トランス-2-ヘキセナールとシス-3-ヘキセナールを総称して、青葉アルデヒドと呼ばれています。分子量は98.14g/molです。
トランス-2-ヘキセナールは消防法で「第4類危険物第2石油類」に該当します。
ヘキセナールの使用用途
トランス-2-ヘキセナールとシス-3-ヘキセナールは、ともに草や葉の香りの主成分です。植物に広く存在し、香りを添加する目的で、香料として幅広く用いられています。
トランス-2-ヘキセナールとシス-3-ヘキセナールはどちらも植物の香りがありますが、トランス-2-ヘキセナールは芳香に、シス-3-ヘキセナールは不快臭に分類されます。植物内でシス-3-ヘキセナールからトランス-2-ヘキセナールに異性化する酵素が特定されて以降、芳香を持つトランス-2-ヘキセナールをより多く含む農作物の開発が推進されてきました。
ヘキセナールの性質
トランス-2-ヘキセナールの融点は-39.8°Cで、沸点は146°Cであり、引火点は43°Cです。無色~黄色の液体です。アセトンやエタノールに溶解しますが、ほとんど水に溶けません。シス-3-ヘキセナールの沸点は126°Cです。
ヘキセナールの構造
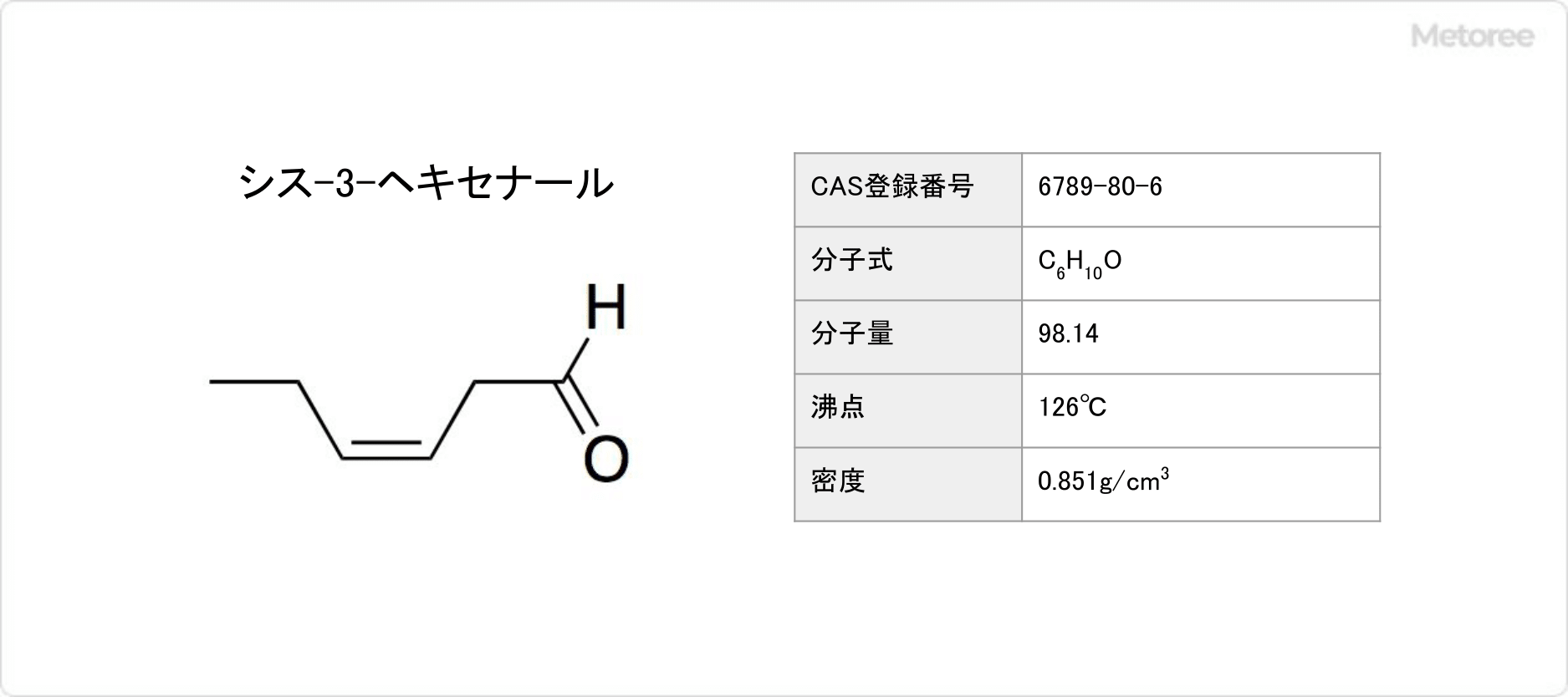
図2. シス-3-ヘキセナールの基本情報
ヘキセナールは脂肪族アルデヒドの一種です。トランス-2-ヘキセナールの25°Cでの密度は0.846g/mLで、シス-3-ヘキセナールの密度は0.851g/mLです。
シス-3-ヘキセナールはトランス-2-ヘキセナールに異性化します。シス-3-ヘキセナールのアルコールであるシス-3-ヘキセン-1-オール (英: cis-3-Hexen-1-ol) は安定です。青葉アルコールとも呼ばれ、同様の香りを有するため、広く香料に利用されています。
ヘキセナールのその他情報
1. ヘキセナールの歴史
1870年ごろにラインケ (英: Reinke) は、新緑の季節に樹木から出る香りの正体を突き止めるため、樹木から若葉を採取して、精油を水蒸気蒸留やエーテル抽出で集めました。1881年に香りがアルデヒドに由来する可能性を指摘しています。
テオドール・クルチウス (英: Theodor Curtius) は香り物質の構造決定に取り掛かりました。1912年にシデの葉に水蒸気を吹き込んで精油を抽出して、抽出液中から2-ヘキセナールを同定し、青葉アルデヒド (英: Blatter aldehyd) と名付けました。
1960年に畑中顯和は、化学合成したトランス-2-ヘキセナールと茶から抽出された青葉アルデヒドが同じだと報告しています。したがって、青葉アルデヒドはトランス体だと証明されました。
2. 天然のヘキセナール
天然にトランス-2-ヘキセナールは、トマト、キュウリ、キャベツのような野菜類に存在します。またバナナ、リンゴ、イチゴのような果物や茶葉にも含まれており、カメムシの匂いの主成分です。
シス-3-ヘキセナールは、クローバー、ブナ、ホウレンソウ、クリを代表とする多種多様な植物から広く見つかっています。生の茶葉、カシの葉、たらの芽にも含まれ、トマトの香り成分です。フェロモンに多くの昆虫が使用しています。
3. ヘキセナールの合成法
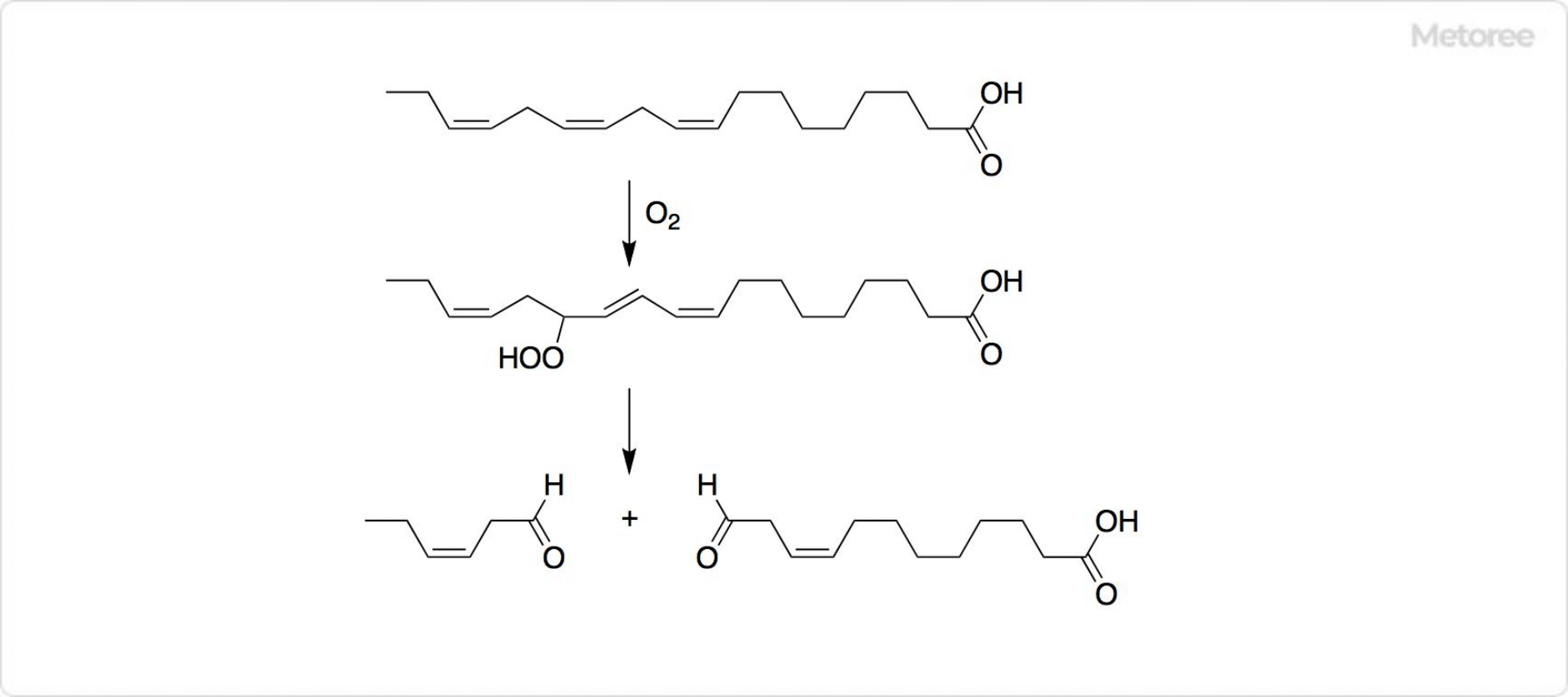
図3. ヘキセナールの合成
トランス-2-ヘキセナールはエチルビニルエーテルなどから合成されます。シス-3-ヘキセナールは3-ヘキセン-1-オールの酸化によって合成可能です。
リノレン酸からリポキシゲナーゼとヒドロペルオキシドリアーゼの作用によって、ヒドロペルオキシドを経由してシス-3-ヘキセナールは生合成されます。





