ホスホン酸とは
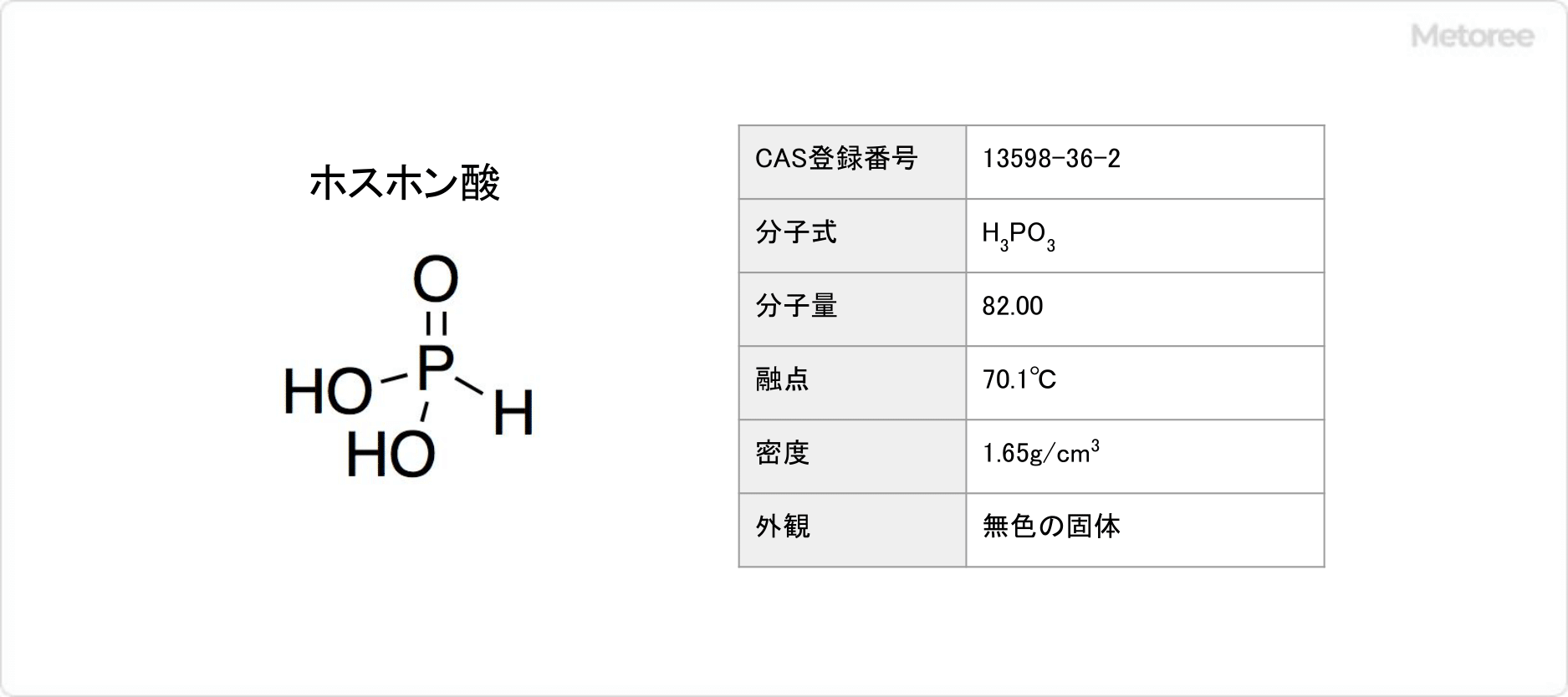
ホスホン酸とは、化学式がH3PO3で表される、酸化数が+3のリンのオキソ酸です。
分子量は82.00g/molで、密度は1.65g/cm3です。三塩化リンの加水分解により得られます。溶液中では亜リン酸 (英: phosphorous acid) との互変異性を示します。
有機リン化学でホスホン酸は、一般式がR-P(=O)(OH)2 (Rは有機基) と示される一連の有機リン化合物の総称です。
ホスホン酸の使用用途
ホスホン酸は還元性が強いため、無電解めっきの還元剤としての使用可能です。硝酸銀や硫酸銅の水溶液から、それぞれ銀や銅を析出させて、メッキを施せます。
P-アルキルホスホン酸ジアルキルエステル (R-P(=O)(OR’)2)は、工業的に重要な中間体です。P-アルキルホスホン酸ジアルキルエステルはホーナー・ワズワース・エモンズ反応 (英: Horner–Wadsworth–Emmons reaction) の基質であり、ホーナー・エモンズ試薬と呼ばれ、アルケンの原料になります。ホーナー・エモンズ試薬は、香料や医薬品の原料として、多方面で使用されています。
ホスホン酸の性質
ホスホン酸の融点は70.1°Cで、無色の潮解性結晶です。200°Cまで熱すると、分解してホスフィンとリン酸が生じます。
アルカリ塩やカルシウム塩以外は、水に難溶です。酸解離定数はpKa = 1.5と6.79です。
ホスホン酸の構造
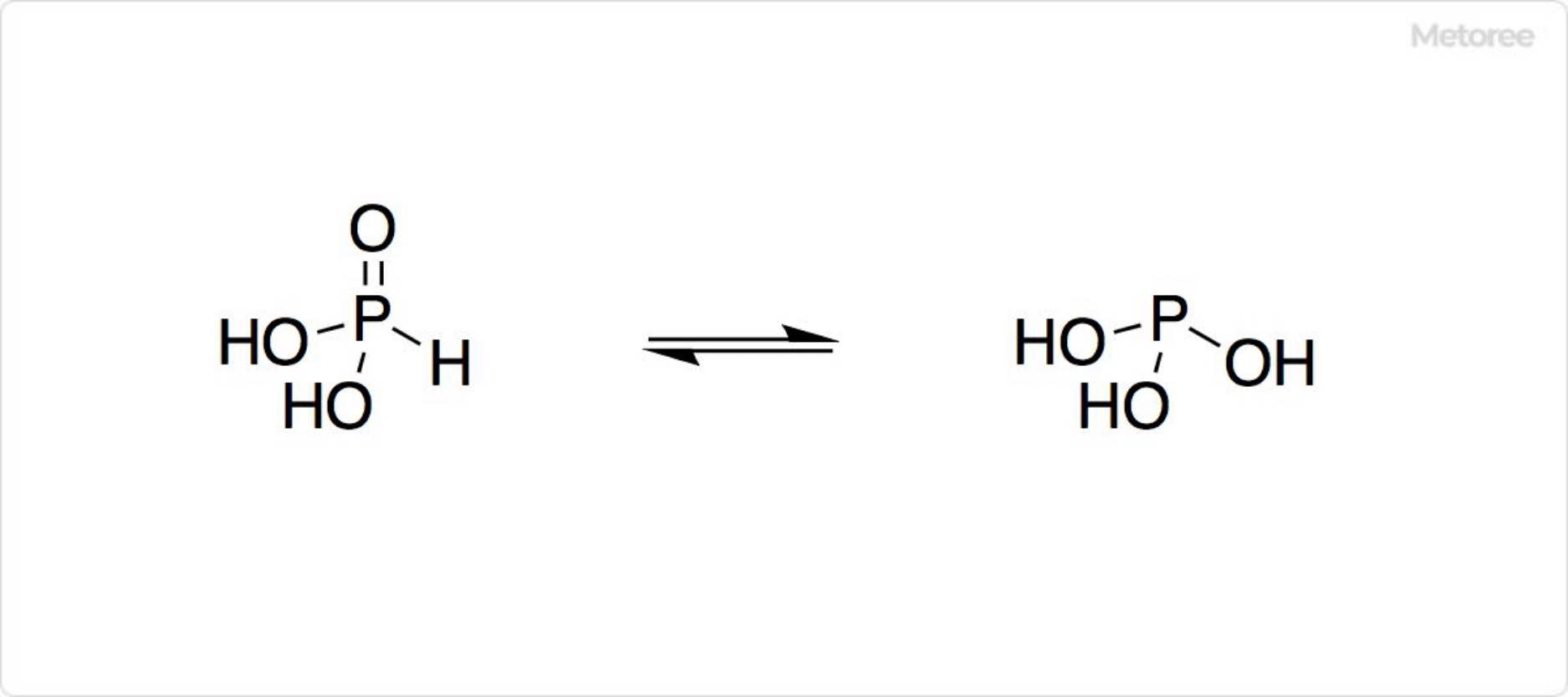
図2. ホスホン酸の構造
ホスホン酸の示性式は、HP(=O)(OH)2と示されます。P-H結合の存在は、一置換塩と二置換塩だけが生成して三置換塩が得られない事実や物理測定から明らかになっています。分子の形は四面体です。
亜リン酸と互変異性体の平衡関係にあります。亜リン酸の化学式はP(OH)3で、ホスホン酸は平衡の中で優位です。
有機リン化学でホスホン酸は、リンと水素の結合とホスホリル基を持つ有機リン化合物の総称です。ホスホン酸の有機誘導体には、リン原子上の水素原子がアルキル基に置換されたアルキルホスホン酸とヒドロキシ基の水素原子がアルキル基に置換されたホスホン酸アルキルが存在します。ホスホン酸アルキルには、1つのみアルキル基が置換したモノエステルと2つともアルキル基が置換したジエステルがあります。
ホスホン酸のその他情報
1. 有機ホスホン酸の合成法
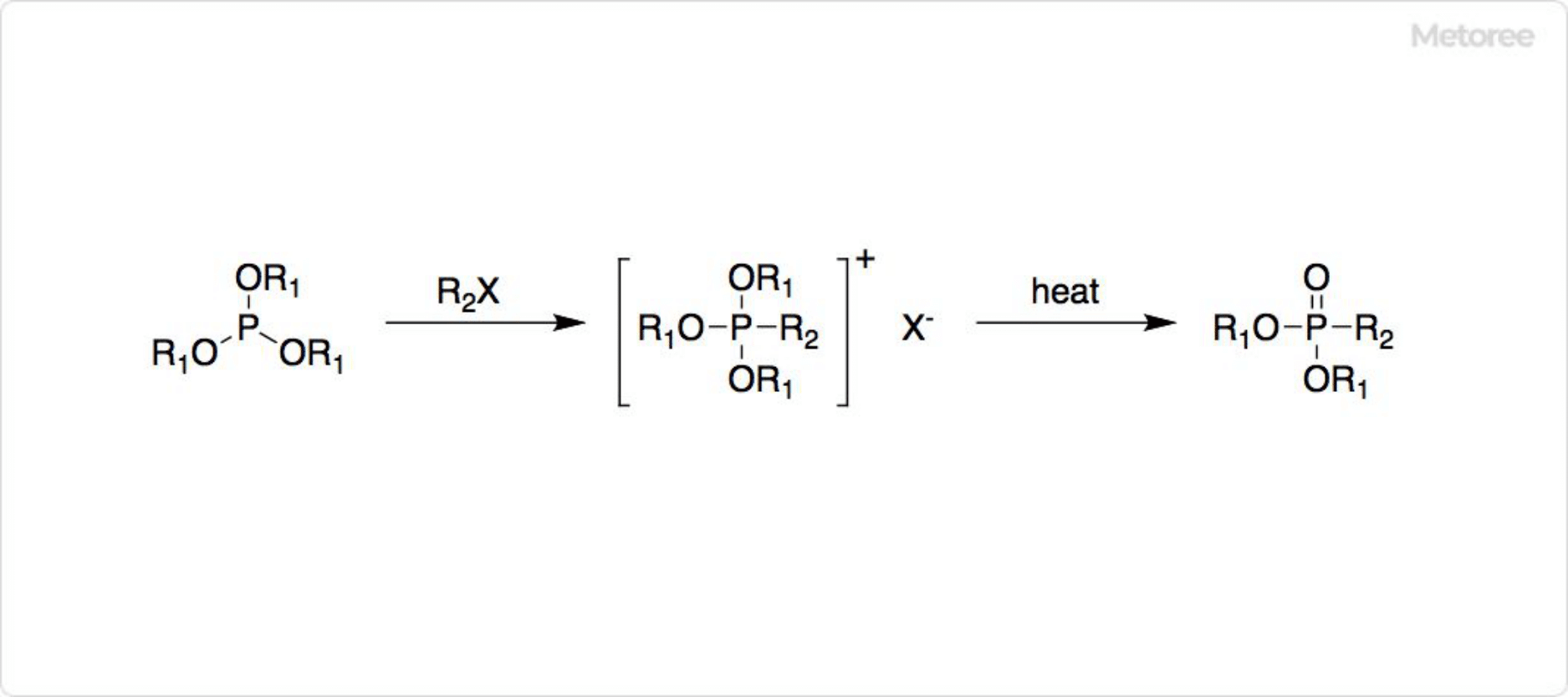
図3. 有機ホスホン酸の合成
有機ホスホン酸とは、リン原子上の水素原子がアルキル基に置換された誘導体のことです。一般式はR-P(=O)(OH)2と表されます。抗ウイルス薬のホスカルネット (英: foscarnet) は、有機ホスホン酸の一例です。有機ホスホン酸の具体例として、CH3P(O)(OH)2 (メチルホスホン酸) やC6H5P(O)(OH)2 (フェニルホスホン酸) が挙げられます。
亜リン酸トリアルキルエステルは、異性化反応によって自発的に酸素原子からリン原子にアルキル基が移動し、アルキルホスホン酸ジアルキルエステルが生じます。亜リン酸トリエステルとハロゲン化アルキルから、P-アルキルホスホン酸のジエステルを合成可能です。この反応をミカエリス‐アルブーゾフ反応 (英: Michaelis-Arbuzov Reaction) と呼びます。
2. ホスホン酸の反応
ホスホン酸はP-H結合の反応性を利用して、原料に用いられています。
カバチニク・フィールズ反応 (英: Kabachnik–Fields reaction) またはプドビック反応 (英: Pudovik reaction) によってアルキル化され、キレート剤として有用なアミノホスホネートが得られます。例えば工業的には、ニトリロトリス(メチレンホスホン酸)を合成可能です。
ホスホン酸をアクリル酸誘導体のマイケル付加でアルキル化すると、カルボキシ基を持つホスホン酸が生成します。