ホロンとは
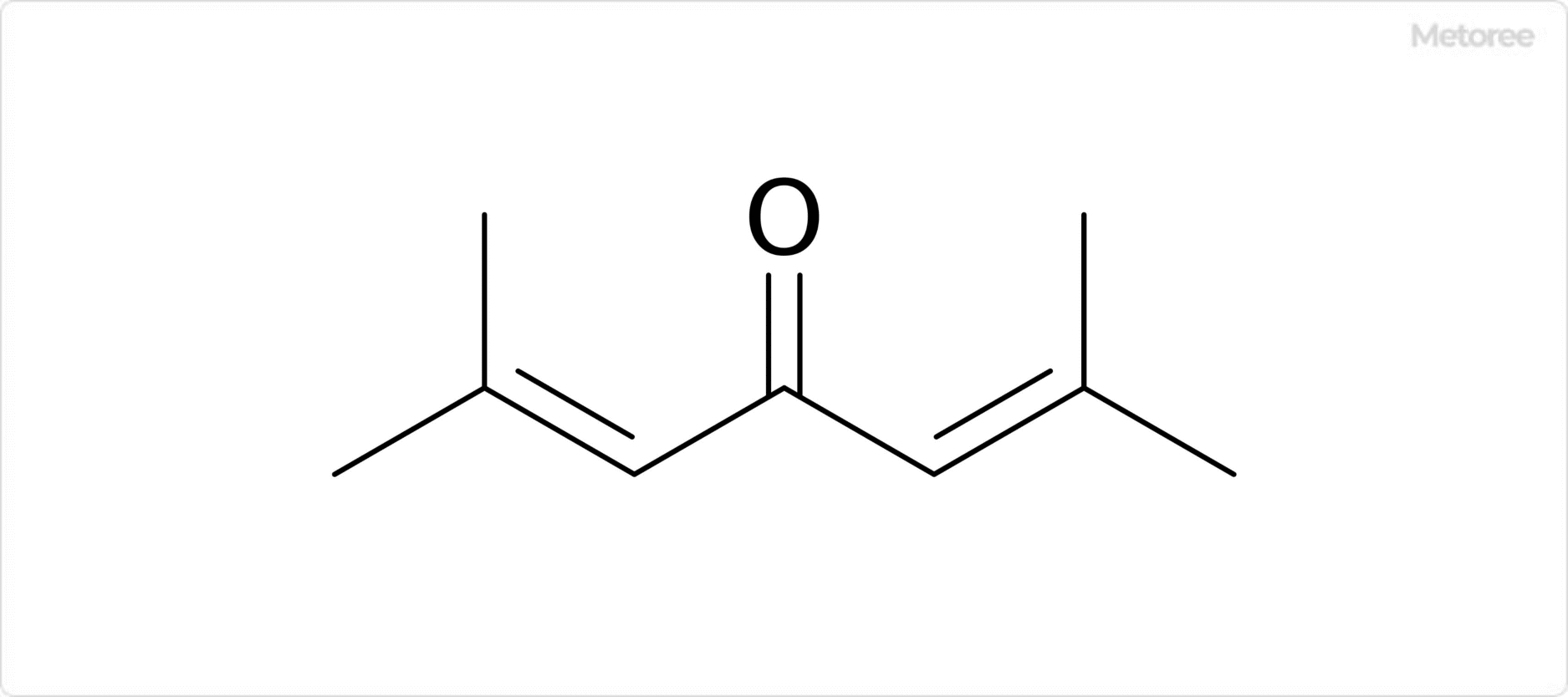
ホロン (英: Phorone) とは、ジイソプロピリデンアセトンの通称です。
ジイソプロピリデンアセトン (英: Diisopropylidene acetone) とは、ケトン化合物の一種で、化学式C9H14Oで表される有機化合物です。分子内に二重結合を2つ有します。
IUPAC命名法による名称は2,6-ジメチル-2,5-ヘプタジエン-4-オンであり、CAS登録番号は504-20-1です。
ホロンの使用用途
ホロンは、生理学実験などにおける強力なグルタチオン枯渇剤 (英: Glutathione depletor) としての用途が知られています。特定のテルペノイド化合物からも得ることが可能な物質でもあります。

図2. グルタチオンの構造
グルタチオンとは、グルタミン酸、システイン、グリシンがペプチド結合した構造を持つトリペプチドであり、チオール基 (-SH基) を持つ物質です。チオール基の還元性によって、グルタチオンは過酸化物や活性酸素種を還元して還元的環境を維持する働きがあります。あるいは、毒物・薬物等の異物を自らのチオール基に結合させて (抱合) 、自分が細胞外に排出されることにより、細胞から毒物や薬物を排出させます。
生理学実験などにおいて、ホロンをラットなどの実験動物に投与すると、体内にあるグルタチオンのチオール基と強力に反応します。このため、ホロンを投与された個体体内のグルタチオンは不活性化され、グルタチオン欠乏の症状を人為的に作り出すことが可能です。グルタチオンの生理作用や疾患との関係などを調べることに用いられます。
ホロンの性質
ホロンの分子量は138.20、融点は28℃、沸点は198~199℃であり、常温での外観は芳香をもつ黄色の結晶、もしくは暗黄色の液体です。
引火性のある物質であり、引火点は79℃です。通常の保管環境下では安定に存在する物質ですが、強酸化剤とは激しく反応します。密度は0.885g/mLです。熱・火花・炎などを避けるべきとされており、危険有害な分解生成物は二酸化炭素や一酸化炭素を始めとする炭素酸化物です。
ホロンの種類
ホロンは、主に研究開発用試薬製品として販売されている物質です。容量の種類には1g、5gなどがあり、実験室で取り扱いやすい容量での提供が中心です。
生化学・生理学実験などの他、有機合成化学実験などででの使用が想定されています。
ホロンのその他情報
1. ホロンの合成
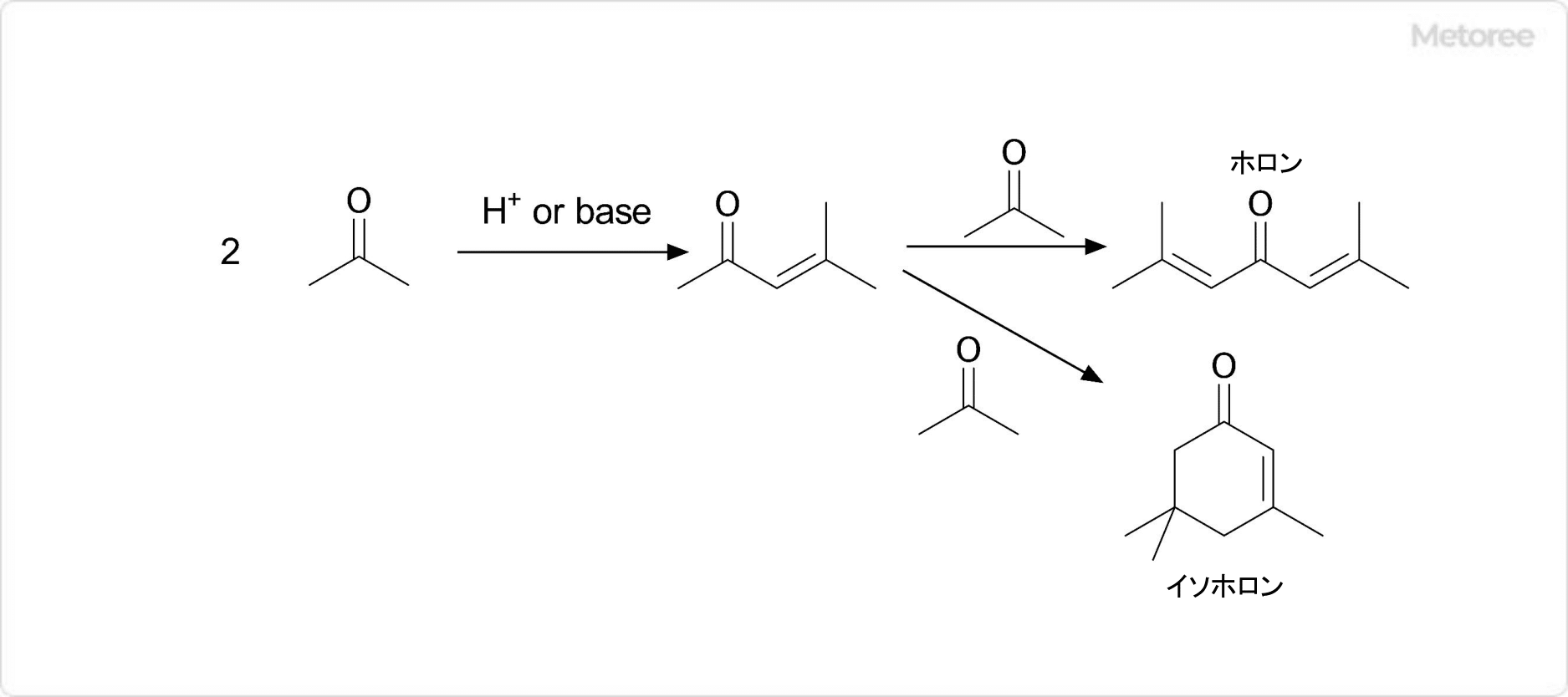
図3. ホロンの合成
ホロンは、塩酸などの酸性条件下にて、アセトン3分子の自己縮合 (アルドール縮合) によって合成することが可能です。まず、2分子のアセトンがアルドール縮合後に脱水して、中間体であるメシチルオキシドが生成する反応が1段回目の反応です。
次に、メシチルオキシドのカルボニル基がエノラート化し、もう1分子のアセトンに求核付加攻撃して脱水する (2段階目のアルドール縮合) ことでホロンが生成します。なお、メシチルオキシドに対してもう1分子のアセトンがエノラート化した後にマイケル付加すると、環化、脱水してイソホロンが生成します。
2. ホロンの化学反応
ホロンは、アンモニアとの縮合反応により、トリアセトンアミンを生じます。トリアセトンアミンは、主に立体障害をもつアミンである2,2,6,6-テトラメチルピペリジンの合成に使われる物質です。
3. ホロンの取り扱い上の注意
ホロンは、GHS分類には該当せず、労働安全衛生法や消防法など各種法令による規制の対象にもなっていない物質です。ただし、取り扱いの際には、適切な局所排気装置や全体換気を設置し、保護メガネや保護衣などの適切な個人用保護具を用いる必要があります。
また、皮膚に付着した場合や眼に入った場合などは直ちに洗浄しなければなりません。