亜酸化窒素とは
亜酸化窒素とは、組成式N2Oで表される常温で気体の窒素酸化物の一種です。
別名として、次亜硝酸無水物、笑気ガス、酸化二窒素、一酸化二窒素もあります。
亜酸化窒素の使用用途
亜酸化窒素は、歯科及び外科、産婦人科の麻酔に多く用いられます。半導体用材料や原子吸光分析用キャリアガスなど工業用にも使用されるほか、漏えい検知、冷媒、風船やタイヤへのガス充填にも使われます。
スペインの有名レストランがソーダサイフォンを使って食品に亜酸化窒素ガスを添加し、空気のように軽い泡の料理を開発しました。亜酸化窒素ガスを食品添加物扱いとし、液状の食材に亜酸化窒素を混ぜてムース状にする料理法をエスプーマと呼びます。日本でも流行した料理法です。
また、亜酸化窒素ガスは大気よりも酸素の存在比率が大きく、熱分解した時に大気よりも酸素分圧の高い混合気体が得られます。そのため、レース車のエンジンなどの内燃機関のブースト用に用いられる場合もあります。
亜酸化窒素の原理
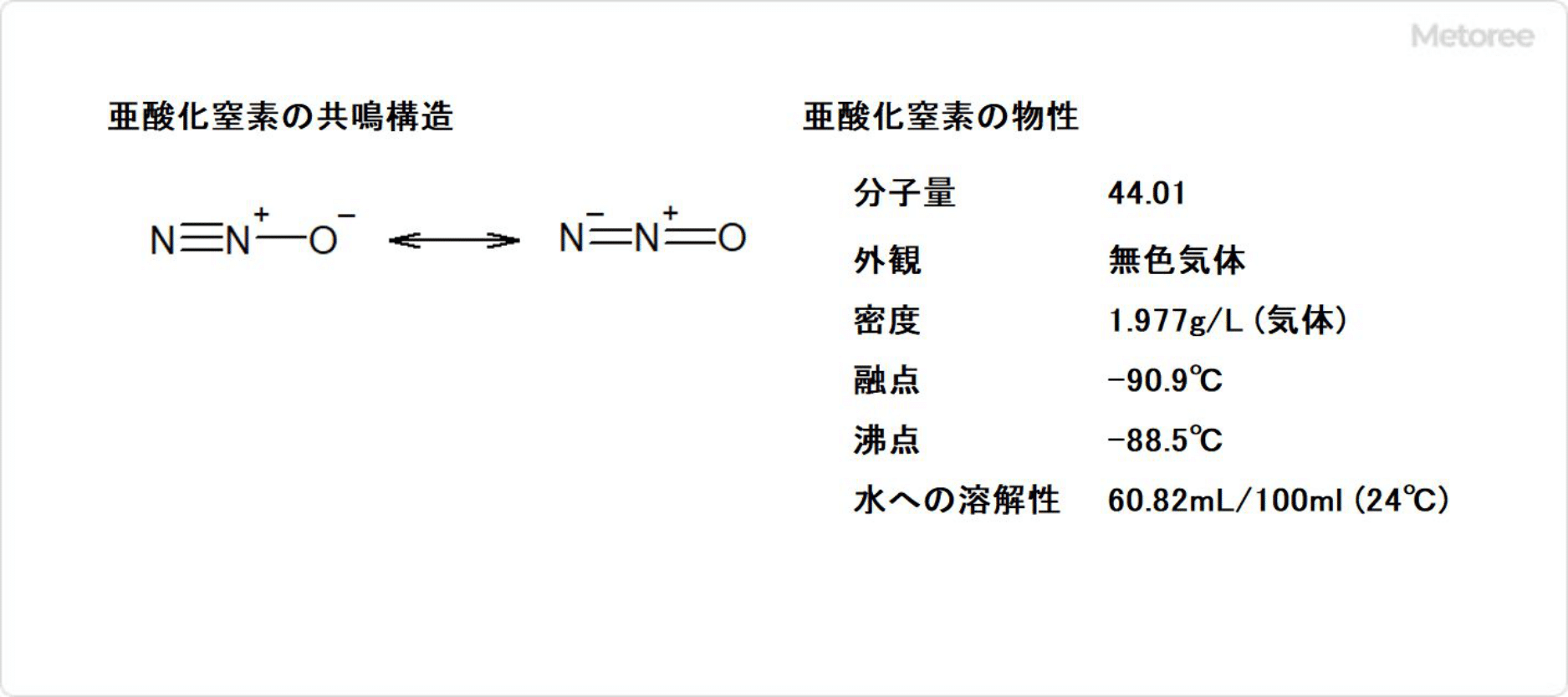
図1. 亜酸化窒素の分子構造と物性
亜酸化窒素は、常温だと特徴的な臭気をもつ無色の気体で、分子構造としては図1のような共鳴構造をとっています。不燃性で安定した気体で、他の窒素酸化物のような毒性はありません。特徴として麻酔作用、鎮痛作用があり、吸入すると顔面の筋肉が痙攣してしまい笑っているようにみえるところから、笑気ガスと呼ばれています。吸入式の全身麻酔に使用します。
650℃に加熱すると分解してNOxの蒸気を生成し、火災や爆発の危険をもたらします。無水亜硫酸、無定形ホウ素、ホスフィン、エーテル、アルミニウム、ヒドラジン、フェニルリチウム、炭化タングステンなど還元剤およびある種の可燃性物質などと激しく反応し、火災や爆発の可能性があるため、大変危険です。
また、この気体は 300℃以上の強酸化剤であり、アンモニア、一酸化炭素、油などと爆発性混合物を生成することがあります。吸入すると多幸感が得られるとされ脱法ドラックとして乱用されたため、現在は指定薬物です。
労働安全衛生法で危険有害物に指定されているほか、2015年から指定薬物になっているので、保管・取り扱いには厳重注意が必要となります。
亜酸化窒素の製造方法
亜酸化窒素の工業的な製造方法としては、硝酸アンモニウムの熱分解法、アンモニア酸化法、スルファミン酸法の3通りがあります。
1. 硝酸アンモニウムの熱分解法
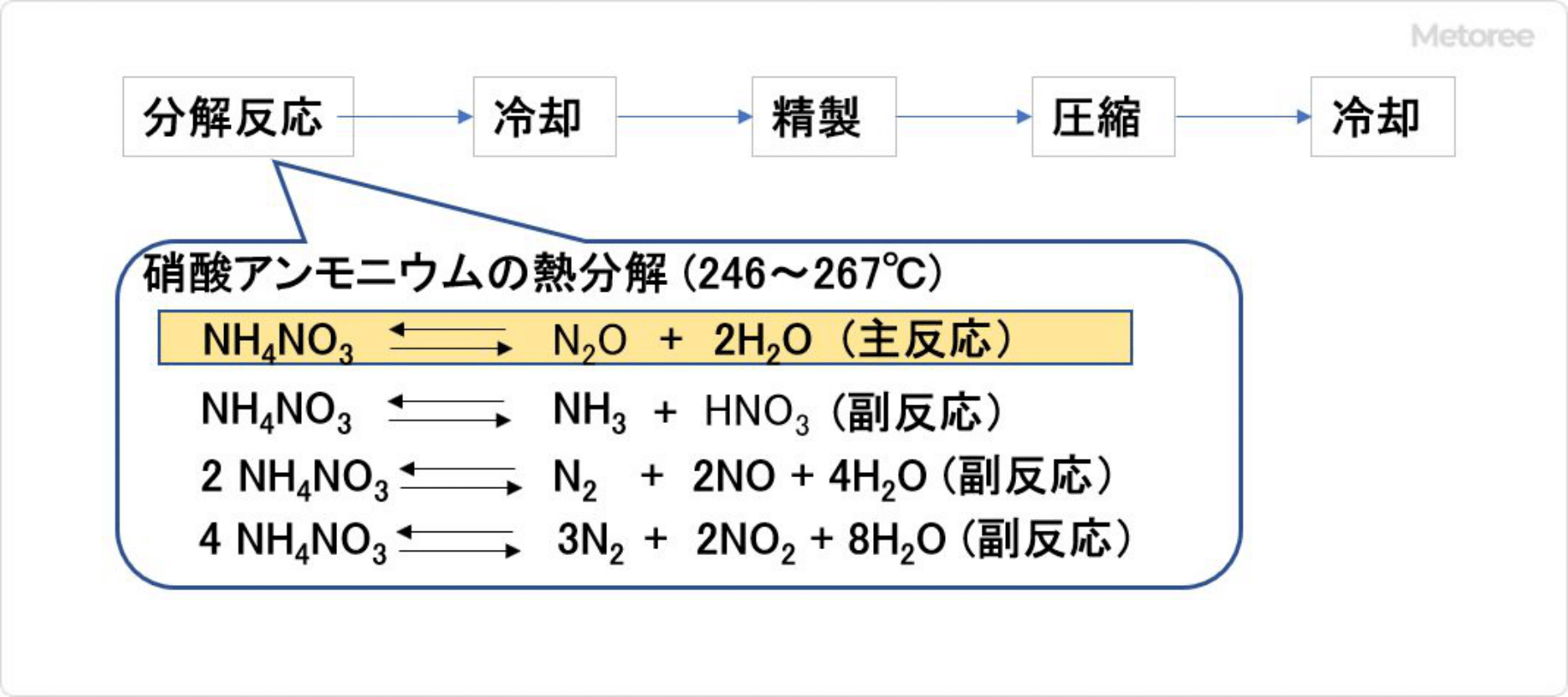
図2. 硝酸アンモニウム熱分解法
硝酸アンモニウム熱分解法は、約250℃に保持した反応槽に原料の80%硝酸アンモニウム水溶液を、一定流量で滴下しながら分解させて亜酸化窒素を得る方法です。反応によって得られたガスは亜酸化窒素純度97~98%であり、不純物として、窒素、アンモニア、酸化窒素、二酸化窒素を含みます。
この粗製亜酸化窒素ガスから水を冷却器で凝縮留去後、強アルカリ水溶液、強酸で洗浄することにより、不純物が除去された精製亜酸化窒素が得られます。
2. アンモニア直接酸化法
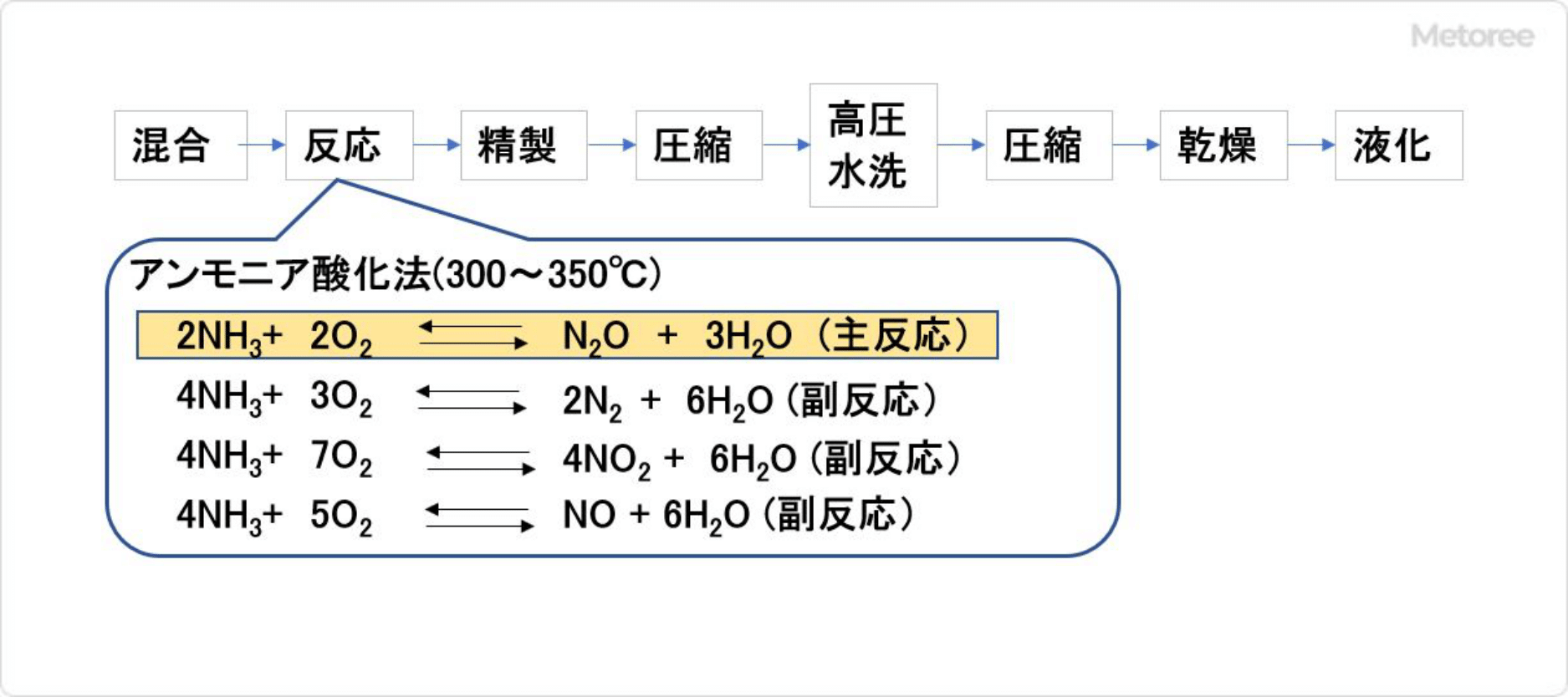
図3. アンモニア直接酸化法
アンモニア直接酸化法はアンモニアを触媒により酸化して亜酸化窒素を得る方法です。反応生成物中の亜酸化窒素濃度が低いことと、触媒の寿命が短いことがプロセス上の課題でしたが、触媒の改良により現在は工業化されています。
不純物を含む粗製亜酸化窒素ガスを加圧下で水に吸収させ、減圧下で水より放散させることにより、酸素、窒素を分離して高純度の亜酸化窒素を得ます。
3. スルファミン酸法
スルファミン酸法はスルファミン酸と硝酸を80~100℃で反応させて亜酸化窒素を得る方法です。
NH2SO3H + HNO3 → N2O + H2SO4 + H2O
参考文献
https://www.mhlw.go.jp/shingi/2004/12/dl/s1217-11d.pdf
https://anzeninfo.mhlw.go.jp/anzen/gmsds/0656.html
https://www.ilo.org/dyn/icsc/showcard.display?p_lang=ja&p_card_id=0067&p_version=2