三酸化硫黄とは
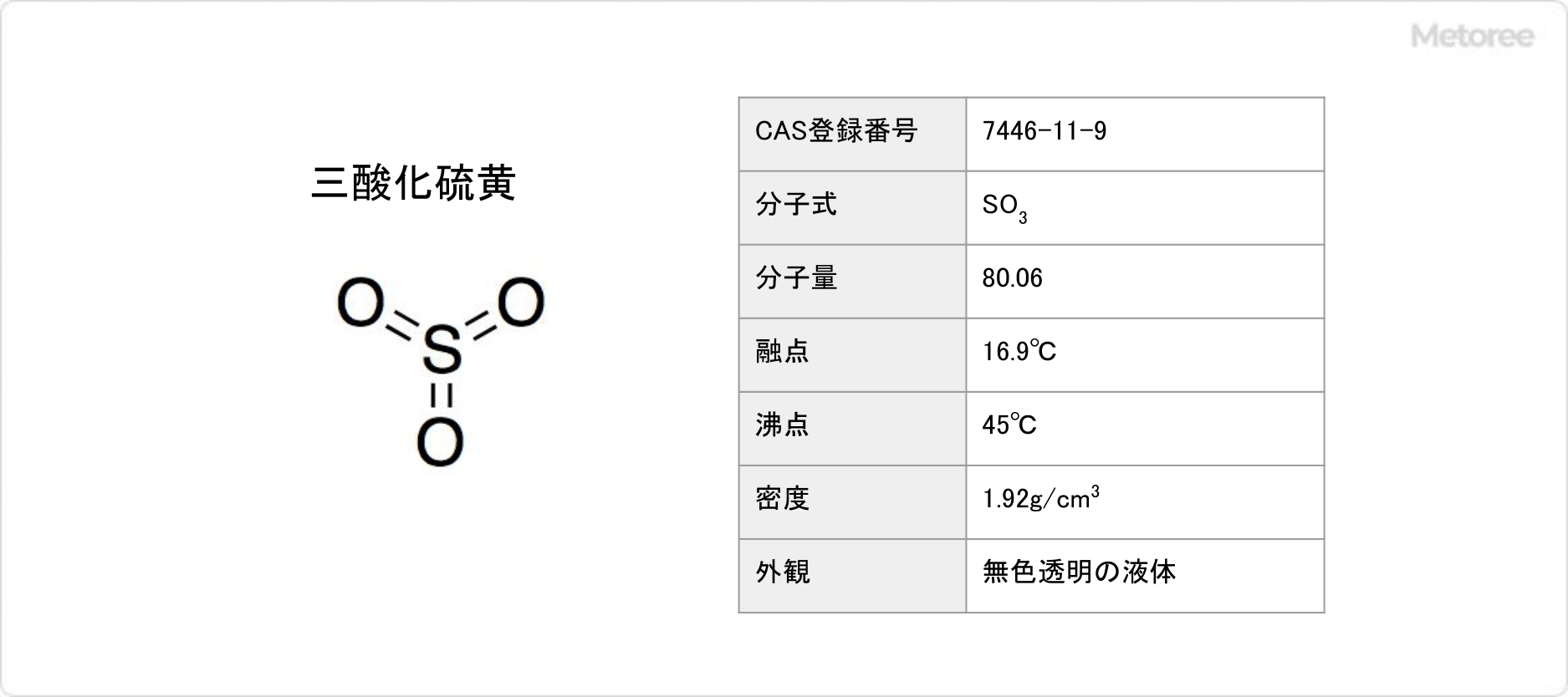
三酸化硫黄とは、化学式がSO3で表される硫黄の酸化物です。
硫酸の無水物に相当し、別名無水硫酸とも呼ばれます。工業的には接触法の中間体として知られています。接触法とは硫酸の製造方法です。
三酸化硫黄はGHS分類で、吸入すると生命に危険(蒸気)、重篤な皮膚の薬傷、目の損傷、呼吸器への刺激の恐れ、長期にわたるばく露または反復ばく露による歯の障害が認められています。大気汚染防止法で特定物質に指定されており、労働安全衛生法、労働基準法、PRTR法、毒物および劇物取締法ではいずれも非該当です。
三酸化硫黄の使用用途
三酸化硫黄は、酸化剤、スルホン化剤、イオン交換樹脂の製造、硫酸の製造などに使用されます。スルホン化剤は工業的な有機合成で広く用いられており、染料や中性洗剤などの工業的な製造工程に使用可能です。
三酸化硫黄は接触法の中間体でもあります。硫黄と酸素から製造した二酸化硫黄を触媒存在下で三酸化硫黄とし、発煙硫酸を経由して水と反応させると、高純度な濃硫酸を製造できます。
三酸化硫黄の性質
三酸化硫黄の融点は16.9°C、沸点は45°Cで、常温で無色透明の液体です。強い刺激臭があり、濃硫酸に溶かすと発煙硫酸が得られます。
三酸化硫黄の吸湿性は高いです。木や綿が熱濃硫酸に触れると発火しますが、三酸化硫黄が炭水化物中の水分を脱水し、炭水化物が燃えやすくなるからです。
三酸化硫黄の構造
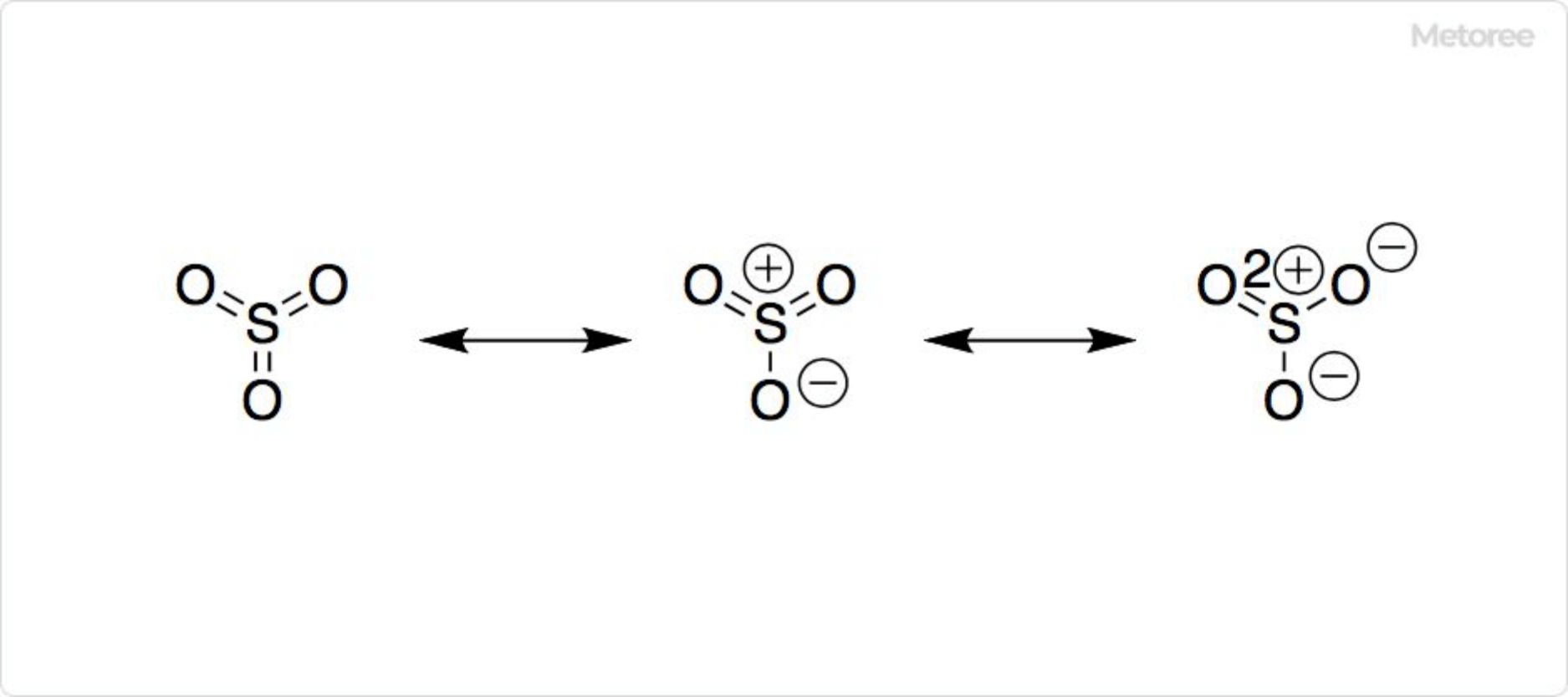
図2. 三酸化硫黄の構造
三酸化硫黄のモル質量は80.06g/mol、密度は1.92g/cm3です。
気体の三酸化硫黄は、硫黄原子が中心の平面正三角形構造を取っていると予測されています。硫黄原子の酸化数は+6であり、電荷は0で、電子対を6個有します。分子軌道法によると、電子対の多くは非結合的な性質を有する典型的な超原子価分子です。3個のS-Oの長さは等しく、1.42Åであり、∠O-S-Oは120°です。
三酸化硫黄の種類
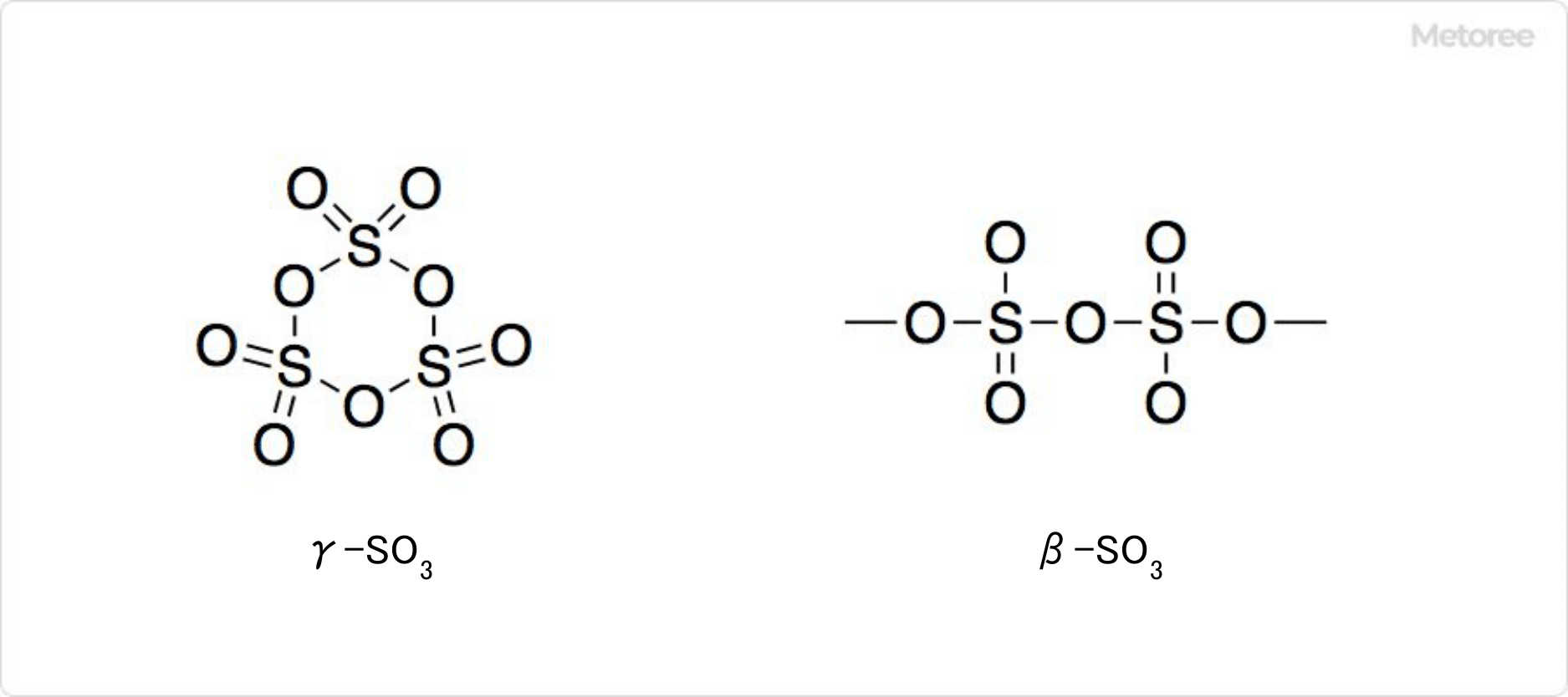
図3. 三酸化硫黄の種類
固体の三酸化硫黄にはα-SO3、β-SO3、γ-SO3の3種類の変態があります。微量の水に依存して、複雑な挙動を示します。気体が凝集して、三量体のγ-SO3を形成します。γ-SO3はS3O9と表される分子結晶です。
27°C以上で痕跡量の水の存在で凝集して、アスベストのような繊維状のα-SO3になります。封管中でβ-SO3を32.5°C以上で放置しても得られます。α-SO3は末端にヒドロキシル基を持つ[S(=O)2(μ-O)]n型の高分子です。
β-SO3もα型と同じく針状結晶です。β-SO3とγ-SO3は、微量の水によって、時間とともに安定なα-SO3に少しずつ相転移します。四面体型のSO4がOによって繋がった無限らせん構造を持っています。
三酸化硫黄のその他情報
1. 三酸化硫黄の合成法
実験室で三酸化硫黄は、硫酸水素ナトリウムの熱分解によって合成されます。ナトリウム以外の金属の硫酸水素塩でも反応は進行しますが、中間体の安定性に反応条件は依存します。
工業的に接触法で、三酸化硫黄を製造可能です。まず、硫黄や黄鉄鉱の燃焼によって、二酸化硫黄を合成して、電気集塵によって精製します。続いて、二酸化硫黄を酸素や五酸化バナジウムを400~600°Cに加熱して酸化すると、三酸化硫黄を合成可能です。
鉛室法の過程でも、二酸化硫黄と二酸化窒素の反応によって、三酸化硫黄が生じます。鉛室法とは、硝酸類や窒素酸化物を使用した硫酸の製造法のことです。接触法が登場したために、現在では鉛室法は廃れてしまいました。
2. 三酸化硫黄の反応
三酸化硫黄は硫酸の無水物で、水と急速な発熱反応が進行します。そのため三酸化硫黄は、酸性雨の原因物質の一つです。340°C以上では、三酸化硫黄、硫酸、水の平衡状態になります。また、二塩化硫黄と三酸化硫黄の反応によって、塩化チオニルが生じます。