チオ尿素とは
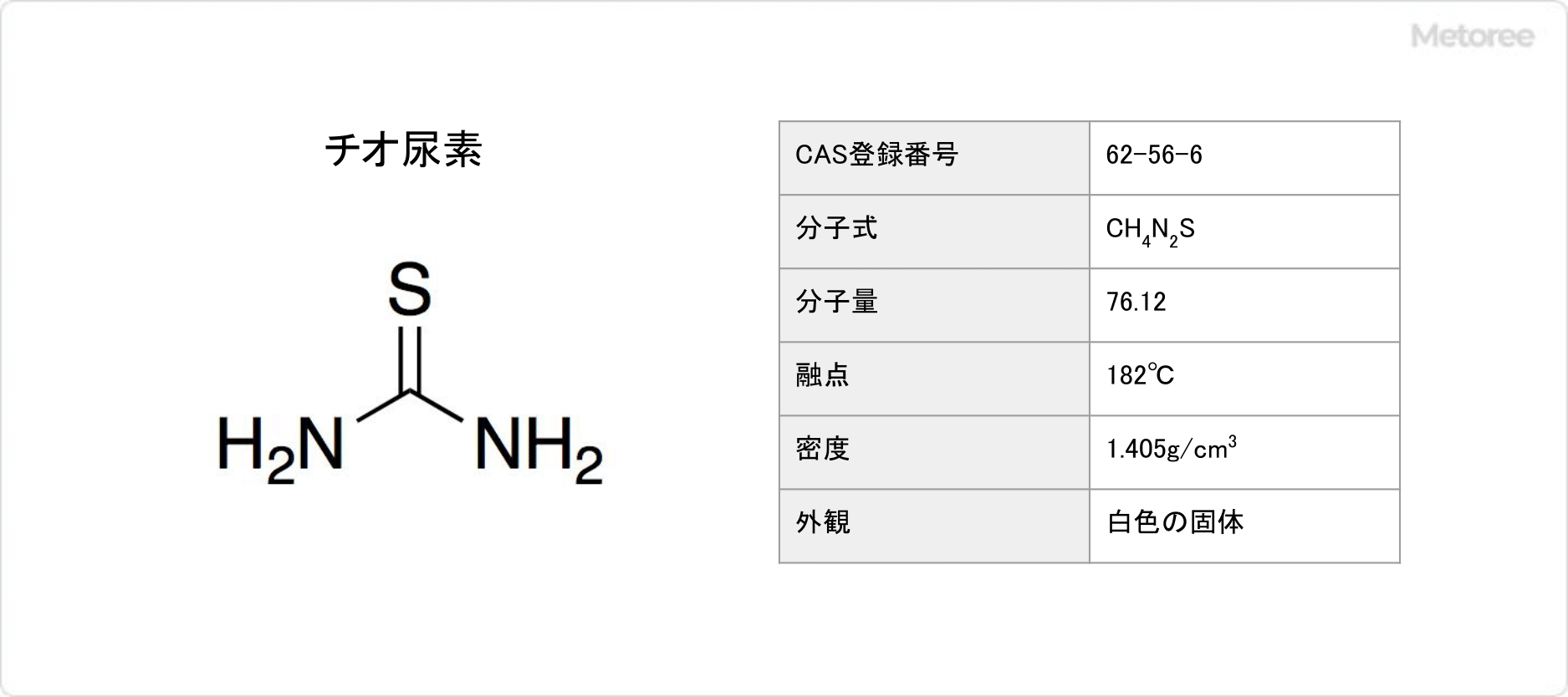
チオ尿素とは、尿素の酸素原子を硫黄原子に置き換えた構造を有する有機化合物です。
チオウレアやイソチオ尿素とも呼ばれています。アンモニアの存在下で、シアナミド (英: Cyanamide) と硫化水素から合成する製造方法が広く知られています。石灰窒素と硫化水素または水硫化カルシウムからも製造可能です。
加水分解が起こりにくく、環境中に排出された場合には、藻類に高い毒性を示します。ヒトが摂取した際には、代謝によって生成するシアナミドの影響で、甲状腺機能が低下します。
チオ尿素の使用用途
チオ尿素の多くは、ウレタン樹脂の製造に用いられています。ウレタン樹脂とは、ウレタン結合を持つ重合体のことで、ポリウレタンやウレタンゴムとも呼ばれます。
また、チオ尿素は、医薬品 (サルファチアゾール、メチオニン、チオウラシル) 、殺鼠剤 (サルファナフチルチオ尿素) 、染料 (硫化染料、インジゴ) 、有機ゴム添加剤 (ジフェニルチオ尿素など) に使用可能です。さらに、写真薬品の原料、および各種有機合成原料 (チオグリコール酸アンモンなど) としても、幅広く利用されています。そのほか、界面活性剤、金属防錆剤、ボイラーの清浄剤の原料に用いられています。
ビスマス、パラジウム、アンチモン (III) などの分析用試薬も用途の1つです。
チオ尿素の性質
チオ尿素は水やエタノールに可溶です。融点は182°Cで、常温では白色の固体です。加熱すると分解し、窒素酸化物 (NOx) や硫黄酸化物 (SOx) などの有毒なガスが生じます。
チオ尿素とハロゲン化アルキル (英: alkyl halide) の反応によって、イソチオウロニウム (英: isothiouronium) が生成します。イソチオウロニウムの加水分解によって、対応するチオールを合成可能です。硫黄源に硫化水素やその塩を使用する場合とは異なり、スルフィドが生成しません。
チオ尿素の構造
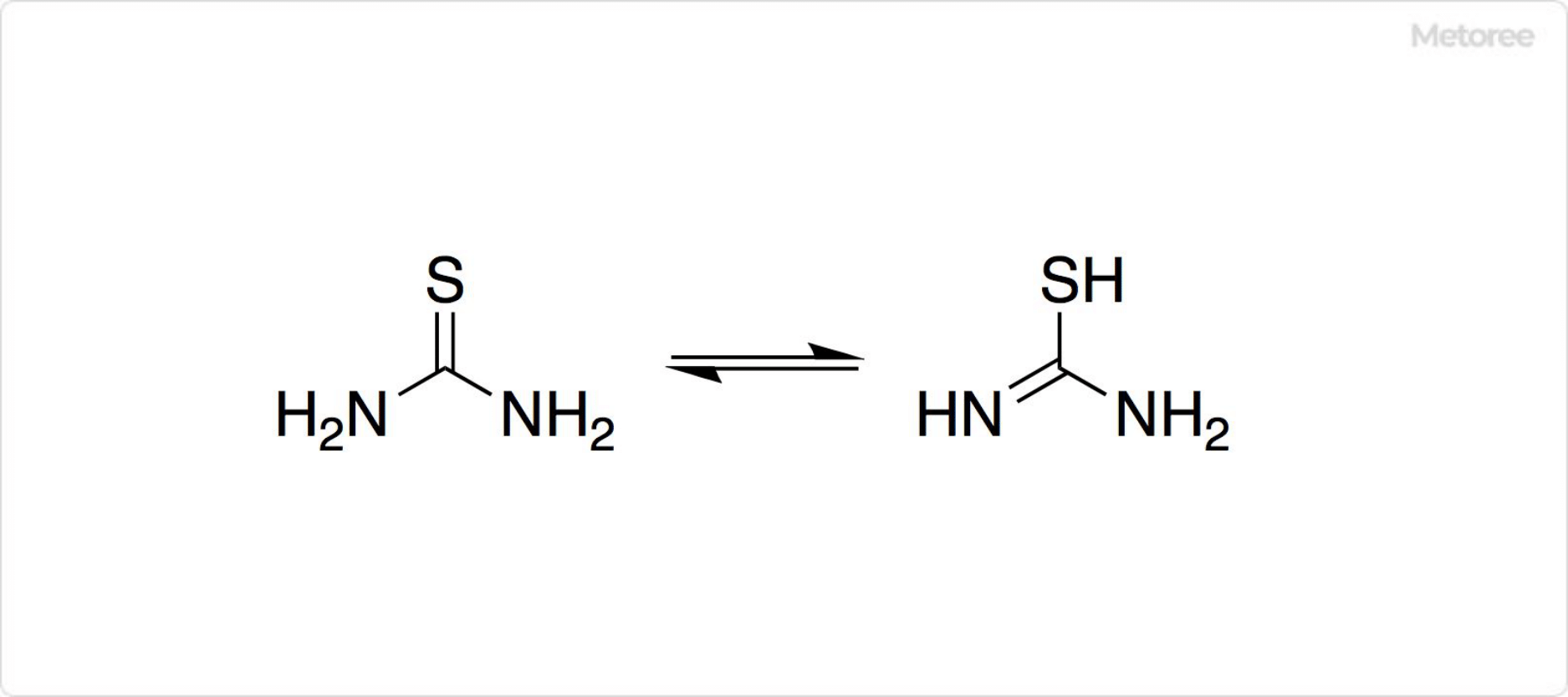
図2. チオ尿素の構造
チオ尿素の化学式はCH4N2Sです。モル質量は76.12g/molで、密度は1.405g/mlです。
R2N−C(=S)−NR2のような構造を有する化合物の一般名として、チオ尿素と呼ぶ場合もあります。R2N−C(=S)−NR2のRは、メチル基やエチル基などです。近年では、有機分子触媒のための基本骨格として、チオ尿素が注目されています。
チオ尿素は平面分子です。C=Sの結合距離は1.71Å、C-Nの平均結合距離は1.33Åです。チオ尿素には互変異性体が存在します。水溶液中ではチオール型よりチオン型が多く、平衡定数Keqは1.04×10−3と計算されています。
チオ尿素のその他情報
1. チオ尿素を用いた還元反応
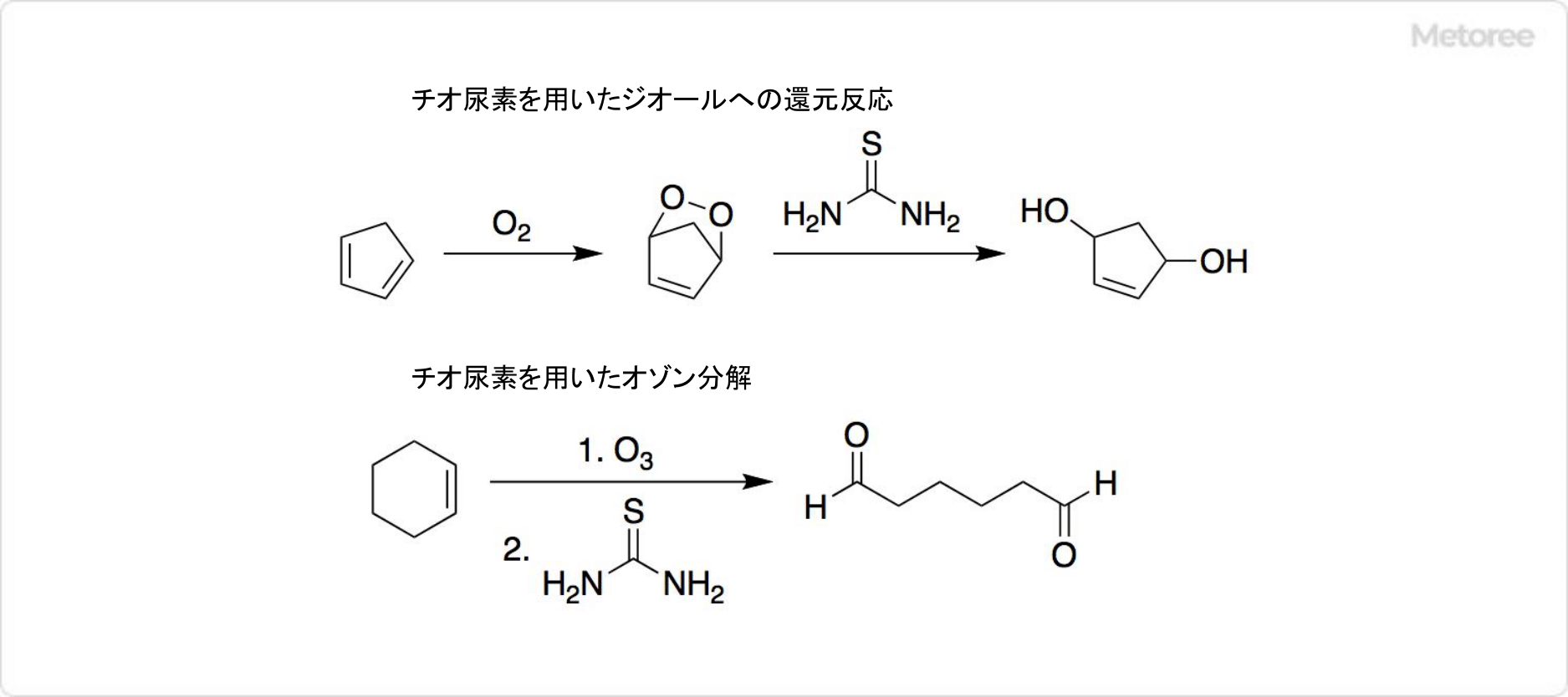
図3. チオ尿素を用いた反応
チオ尿素によって、過酸化物を対応するジオールに還元できます。この反応の中間体は、不安定なエンドペルオキシドです。
オゾン分解ではチオ尿素を還元剤として使用すると、カルボニル化合物を生成します。オゾン分解にはジメチルスルフィドも有効ですが、沸点が37°Cで揮発性が高く、不快な臭いがあります。その一方で、チオ尿素は無臭で揮発しにくいです。
2. 硫黄源としてのチオ尿素
ハロゲン化アルキルのチオールへの変換など、硫黄原子の供給源としてチオ尿素を使用可能です。例えば、1,2-ジブロモエタンからエタン-1,2-ジチオールを合成可能です。
チオ尿素と金属イオンが反応すると、硫化物の供給源として機能します。具体的には、水溶液中の水銀イオンをチオ尿素で処理すると、硫化水銀を生成します。このような硫化反応は、多くの金属硫化物の合成に適用でき、通常は水と加熱が必要です。
チオ尿素とβ-ジカルボニル化合物の縮合によって、ピリミジン誘導体を合成可能です。まずチオ尿素のアミノ基が、カルボニル基と縮合します。その後、環化と互変異性化が進行し、脱硫によってピリミジンが得られます。チオ尿素とα-ハロケトンの反応では、アミノチアゾールを合成可能です。