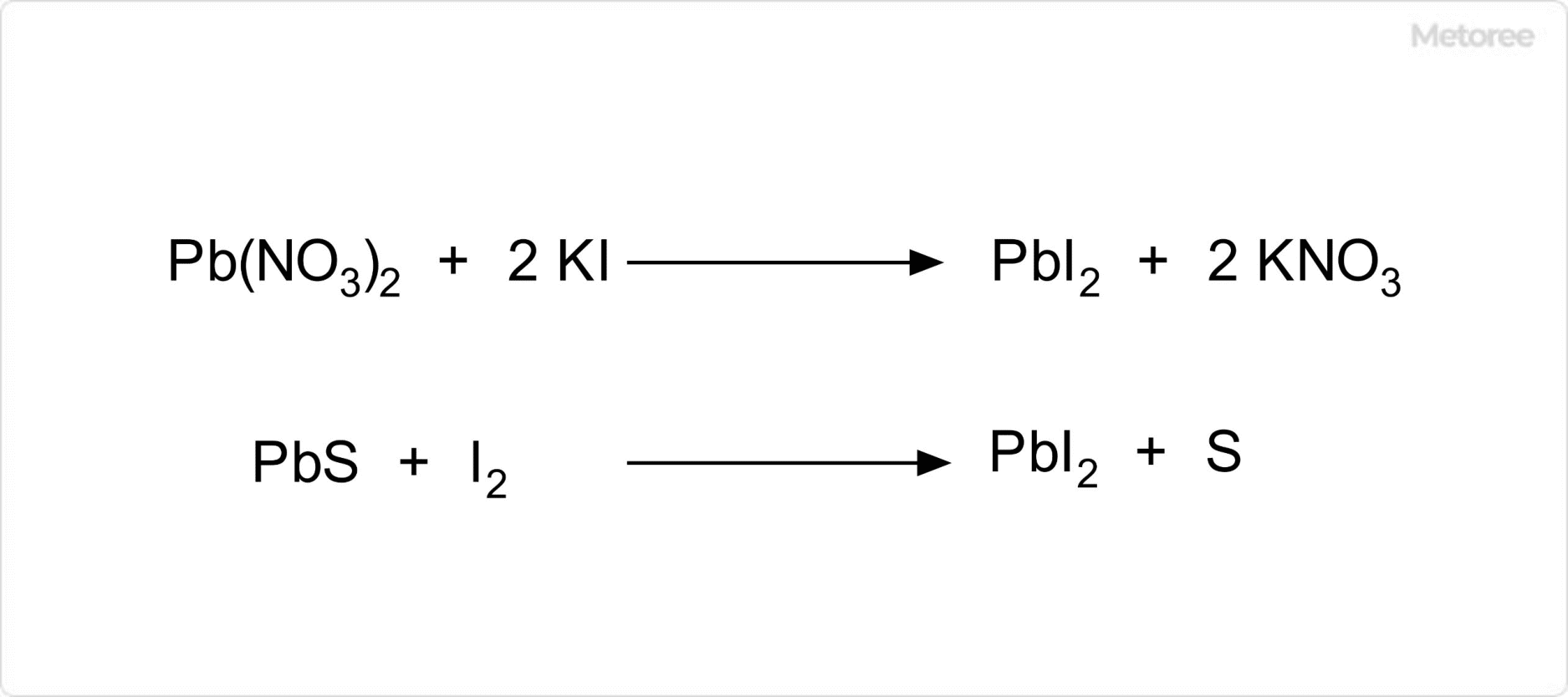ヨウ化銀とは
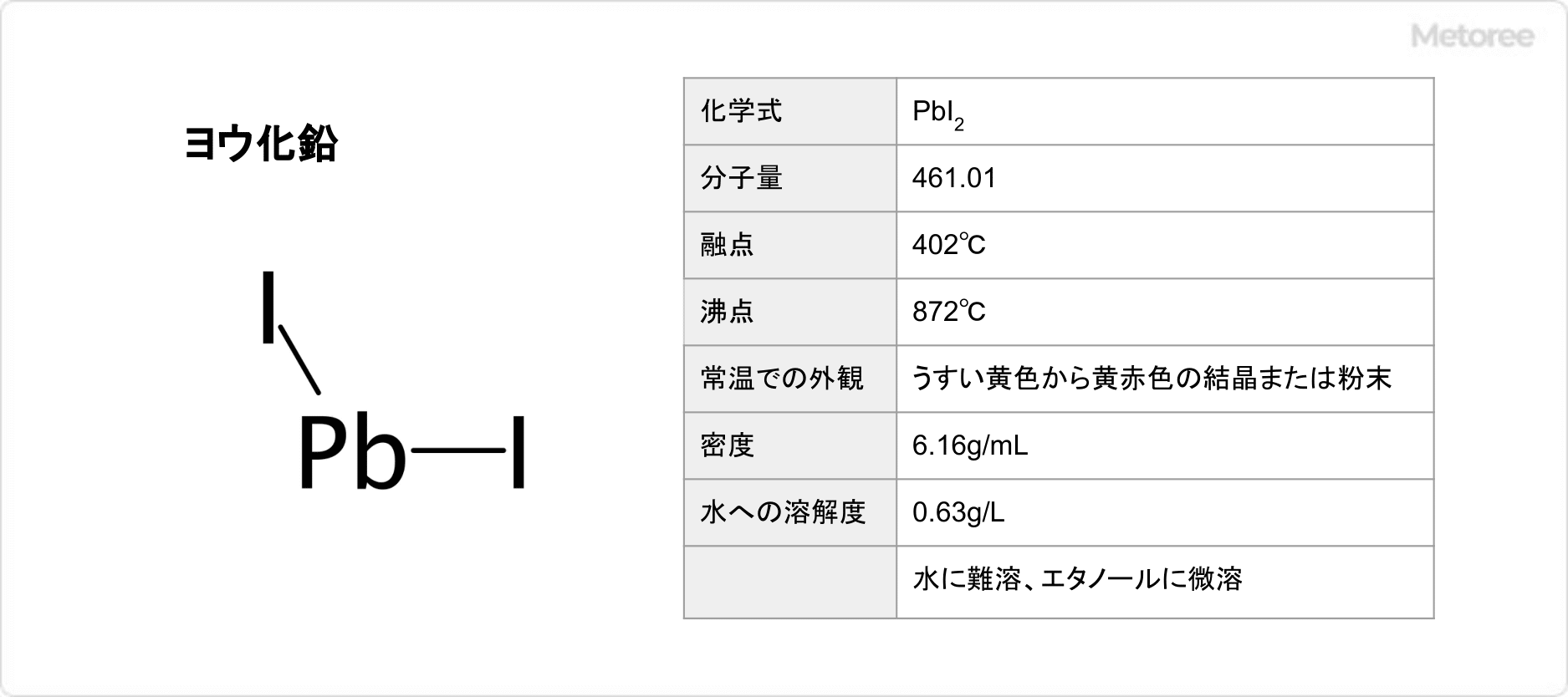
ヨウ化銀とは、化学式がAgIで表される無機化合物です。
天然ではヨウ化銀鉱 (英: Iodargyrite) やミュース石 (英: Miersite) として存在する場合もあります。遮光下で硝酸銀(I)水溶液にヨウ化カリウム水溶液を加え、沈殿として製造可能です。
ヨウ化銀はGHS分類で生殖毒性、特定標的臓器・全身毒性 (反復ばく露) が認められています。ヨウ化銀の法規制は、毒物および劇物取締法で劇物に指定されています。労働安全衛生法、労働基準法、PRTR法では、いずれも非該当です。
ヨウ化銀の使用用途
ヨウ化銀は、医薬用X線フィルム、写真乳剤、導電性ガラスの製造、人工降雨のための凍結核などに使用可能です。
他のハロゲン化銀と同様に光と反応して、感光核を作ります。X線フィルムや写真乳剤は、ヨウ化銀の光反応性を利用しています。またヨウ化銀は、氷や雪の結晶と類似した結晶格子 (六方晶形) を取り、雪片を成長させやすいです。したがって、人工降雨の結晶核として使用されます。
ヨウ化銀の性質
ヨウ化銀は淡黄色の結晶で、光反応性を有する化合物です。光を照射すると光化学反応 (英: photoreaction) を起こして、黄緑色を経由して黒色化します。融点は552°Cで、沸点は1,506°Cです。
ハロゲン化銀の中で、最も難溶です。濃アンモニア水にはほとんど溶けません。濃硝酸、チオ硫酸ナトリウム、シアン化カリウム、熱濃ヨウ化カリウム水溶液に溶解します。
ヨウ化銀の結晶構造は氷に似ています。そのため、水が結晶化するときに、種になりやすいです。大気中にヨウ化銀の粒子を散布すると、この粒子を核にして雲が生じ、人工降雨に利用できます。ヨウ化銀は毒性を持っていますが、人工降雨に使う量はとても微量であり、異常摂取をしない限り人体に影響を与えません。
ヨウ化銀の構造
ヨウ化銀はハロゲン化銀の一種で、銀のヨウ化物です。式量は234.77で、密度は5.675g/cm3です。
固体のヨウ化銀には、多形が3種類知られています。室温〜137°Cでは立方晶系のγ型が、137〜146°Cでは六方晶系のβ型が、146°C〜融点では立方晶系のα型が安定です。ただし相互の相転移速度は遅いため、水溶液から沈殿したヨウ化銀には、これらの多形の混合物が生じています。
α型ではヨウ素原子が、体心立方構造を取っており、その間に銀原子が不規則に配置しています。α型の格子定数はa = 5.03Åです。β型はウルツ鉱型構造で、格子定数はa = 4.59Å、c = 7.52Åです。γ型の結晶は閃亜鉛鉱型構造で、格子定数はa = 6.48Åです。
ヨウ化銀のその他情報
1. ヨウ化銀の錯体の生成
ヨウ化銀は水には溶けませんが、錯体を作って溶解します。アルカリ金属のシアン化物に溶解して、[Ag(CN)2]–を形成します。[Ag(CN)2]–はジシアノ銀(I)酸イオンと呼ばれ、平衡定数はK=3×104です。
アルカリ金属のヨウ化物に溶けるとテトラヨージド銀(I)酸イオンが生じます。テトラヨージド銀(I)酸イオンの化学式は[AgI4]3-で、平衡定数はK=2×10-2です。Na2S2O3 (チオ硫酸ナトリウム) の水溶液にも、[Ag(S2O3)2]3-を形成して溶けます。ビス (チオスルファト) 銀(I)酸イオンと呼ばれ、平衡定数はK=3×10-3です。
臭化銀(I)や塩化銀(I)のようなハロゲン化銀とは違い、錯生成能力が弱いアンモニア水には溶けません。[Ag(NH3)2]+を形成する平衡定数はK=2×10-9です。
2. ヨウ化銀の溶解性
ハロゲン化銀の中で溶解度積が最も小さく、K=1×10-16です。モル体積が大きく、HSAB則 (英: Hard and Soft Acids and Bases Theory) ではAg+とI−がいずれもソフトで、結果的にAg-I結合が共有結合性を帯びています。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7783-96-2.html