制御・計測・センシング
駆動・機械要素・電子制御部品
産業別カテゴリ
電源・エネルギー・熱処理機器
安全・保護・環境対策
材料・素材・ケミカル
電気・電子部品
構造部品・締結要素
ソフトウェア・ネットワーク
サービス
その他
全てのカテゴリ
閲覧履歴
セリンのメーカー16社一覧や企業ランキングを掲載中!セリン関連企業の2025年10月注目ランキングは1位:三井化学株式会社です。
セリンとは、人間のタンパク質を構成している20種のアミノ酸の1つです。
体内で合成できる非必須アミノ酸の一種で、1865年にシルクに含まれるたんぱく質のセリシンの加水分解から発見されました。セリンという名称はラテン語で「絹」を意味する「sericum」に由来します。
セリンは、脳の神経細胞を構成する成分で、細胞膜の構成成分のホスファチジルセリンの原料となる大変重要な成分です。また、角質層では最も多いアミノ酸成分であり、肌の水分量を保つために重要な保湿成分の1つです。
2025年10月の注目ランキングベスト1
| 順位 | 会社名 | クリックシェア |
|---|---|---|
| 1 | 三井化学株式会社 |
100.0%
|
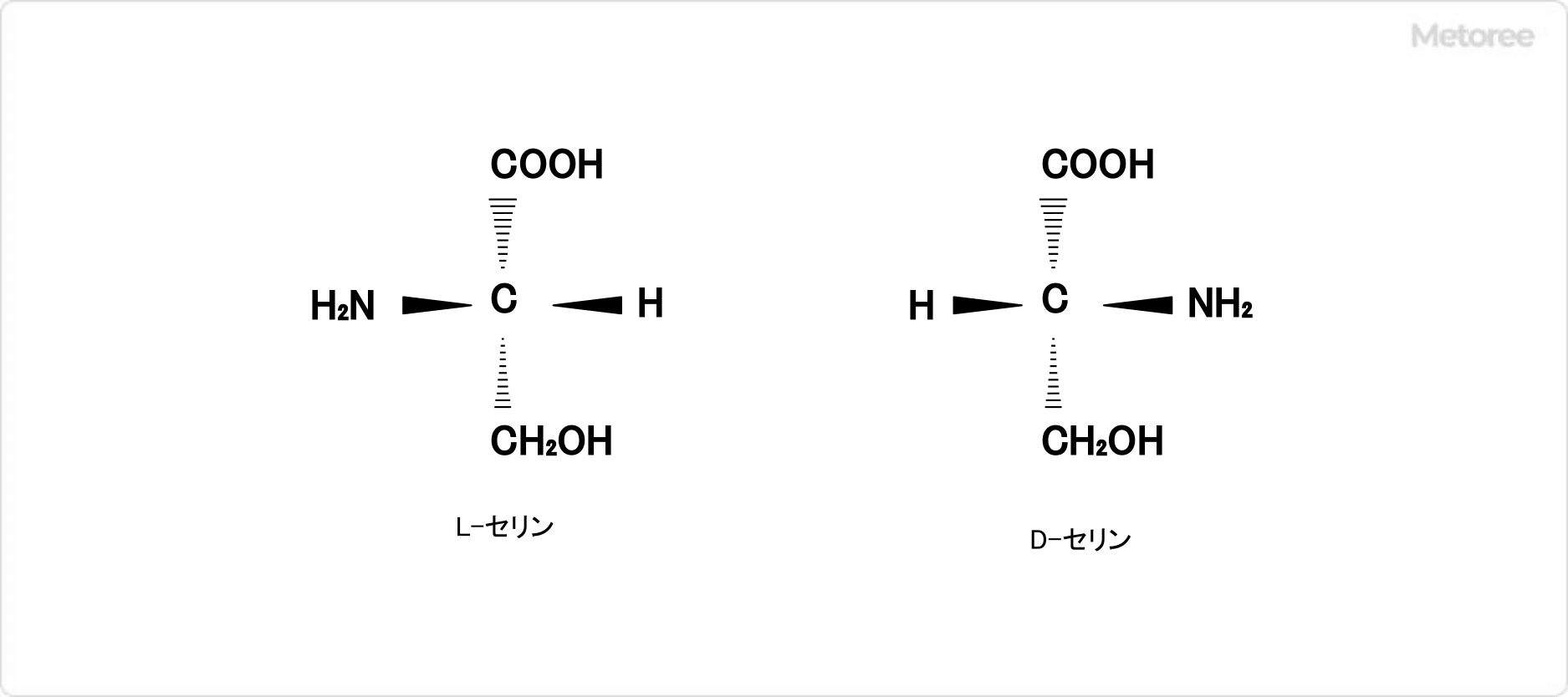
セリンとは、人間のタンパク質を構成している20種のアミノ酸の1つです。
体内で合成できる非必須アミノ酸の一種で、1865年にシルクに含まれるたんぱく質のセリシンの加水分解から発見されました。セリンという名称はラテン語で「絹」を意味する「sericum」に由来します。
セリンは、脳の神経細胞を構成する成分で、細胞膜の構成成分のホスファチジルセリンの原料となる大変重要な成分です。また、角質層では最も多いアミノ酸成分であり、肌の水分量を保つために重要な保湿成分の1つです。
セリンは化粧品、食品、医薬品原料として幅広く使用されています。
化粧品分野ではセリンが保湿成分を持つことから、化粧水、ボディクリーム、ハンドクリーム、ヘアトリートメント、洗顔料など様々な製品に使用されています。食品分野では、風味改良目的で各種食品に用いられている他、栄養強化目的で他のアミノ酸類と併用して栄養ドリンクなどに用いられることがあります。
医療用としては、肝不全用アミノ酸製剤など低栄養状態等におけるアミノ酸補給等を目的として用いられています。また、セリンは神経系において重要な働きをすることから、睡眠の質を高める効果やアルツハイマー病を予防する効果が期待されています。
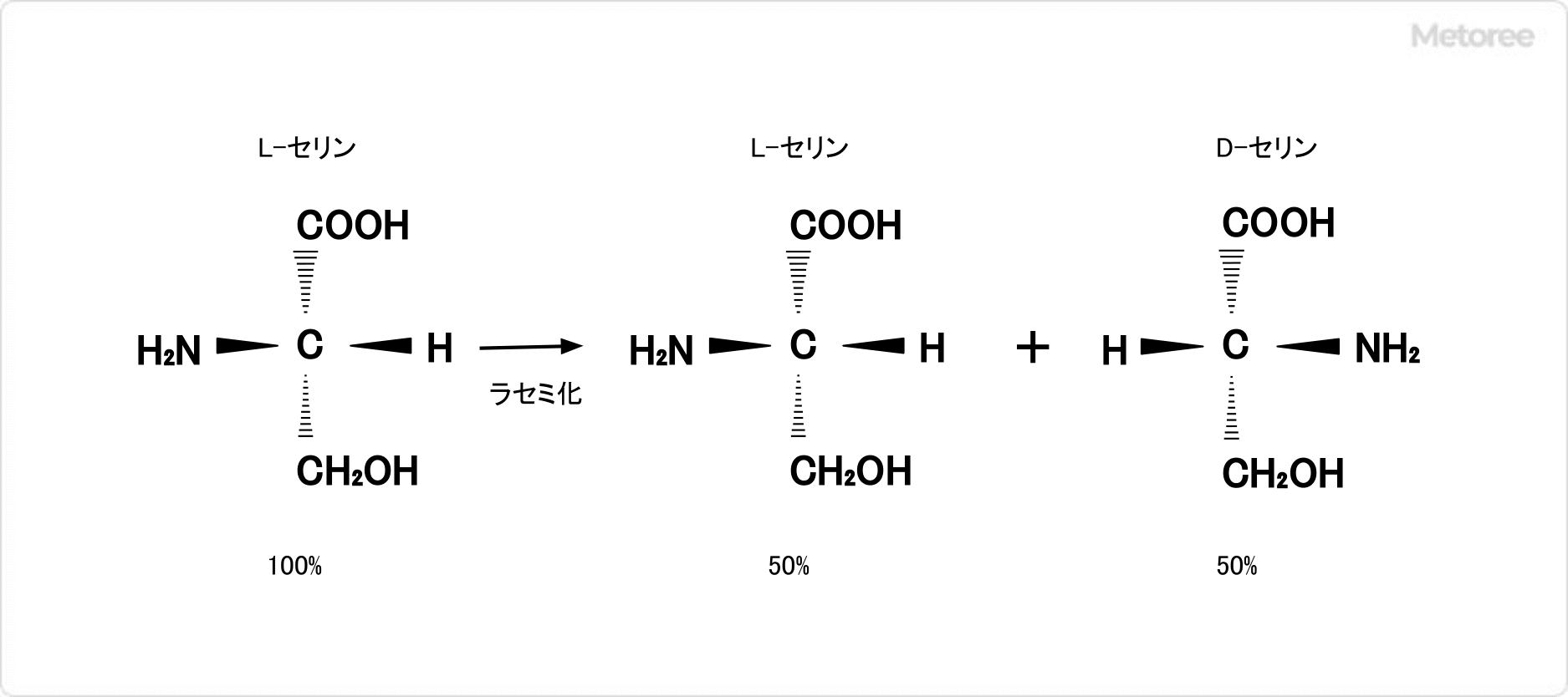
図2. ラセミ化
セリンは側鎖にヒドロキシ基を持つため、アシル化反応を含めて、求核攻撃を受けやすい性質があります。求核攻撃とは、酸素や窒素などの非共有電子対が他の原子や分子の電子欠損部位を攻撃して反応する性質のことです。セリンのヒドロキシ基は、タンパク質やペプチドの構造中で重要な機能を持ちます。アシル化は、有機化合物にアシル基を導入する反応であり、セリン側鎖のアシル化は、蛋白質の修飾や代謝に関与することが知られています。
タンパク質を加水分解するとき、セリンはラセミ化しやすいという特性があります。ラセミ化とは、光学異性体の一方の成分が鏡像関係にある他方の異性体に変化することによって光学不活性な物質 (ラセミ体) になる現象を指します。セリンのラセミ化は、光の照射や酸やアルカリの添加など、物理的または化学的な影響によって起こります。
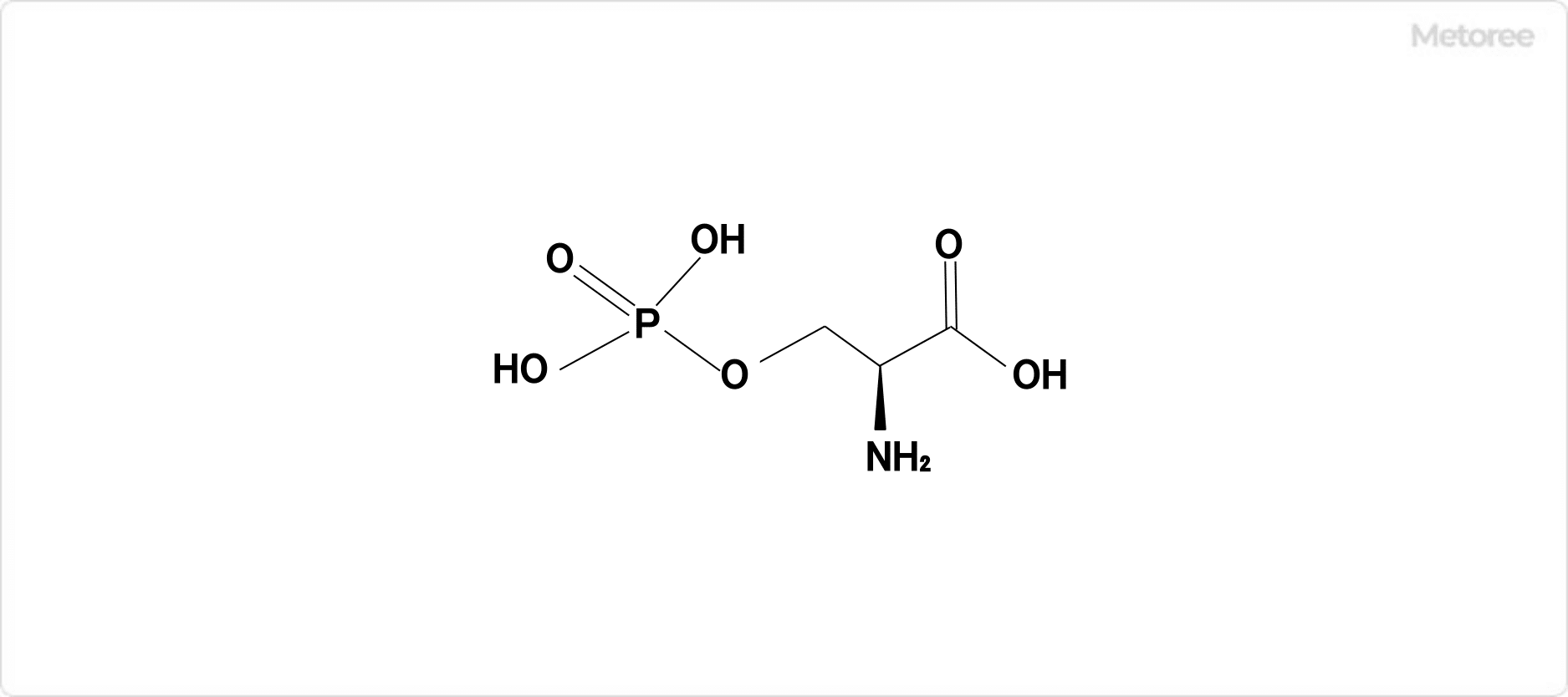
図3. ホスホセリン
セリンプロテアーゼやアセチルコリンエステラーゼなどの酵素において、セリンは活性中心アミノ酸として極めて重要な役割を担っています。セリンプロテアーゼは、タンパク質の分解に重要な役割を果たしている一連の酵素であり、タンパク質を分解する活性部位に共通してセリンが存在しています。一方、アセチルコリンエステラーゼは、4量体のセリン加水分解酵素であり、アセチルコリンを速やかに酢酸とコリンに加水分解します。
乳たんぱく質の一種であるカゼインには、セリンの水酸基がリン酸化されたホスホセリンが含まれています。このホスホセリンは、牛乳に含まれるカルシウムの利用効率を高める働きがあります。具体的には、ホスホセリンがカルシウムイオンを水に溶けやすくするため、体内でよりカルシウム効率的に吸収されるようになります。
セリンは、O型糖鎖と呼ばれるタンパク質中の糖鎖結合アミノ酸の一つです。近年、タンパク質と結合した糖鎖の機能がより注目されるようになってきています。糖タンパク質は、粘液、分泌液、結合組織成分として存在するだけでなく、細胞表層組織や情報伝達、酵素作用の発現においても重要な役割を果たしています。
セリンは、天然に存在するアミノ酸ですが、工業的にも生産されています。セリンは、微生物の発酵によって生産されることが一般的で、年間推定100〜1,000トンが生産されています。また、研究室ではアクリル酸メチルからいくつかのステップを経て、ラセミセリンを調製することができます。
セリンは医薬品や栄養補助食品として広く用いられており、これまでに安全性に関して特段の問題は確認されていません。一般的な使用範囲であれば、人体に対して有害な影響を与えることはないと考えられています。