制御・計測・センシング
駆動・機械要素・電子制御部品
産業別カテゴリ
電源・エネルギー・熱処理機器
安全・保護・環境対策
材料・素材・ケミカル
電気・電子部品
構造部品・締結要素
ソフトウェア・ネットワーク
サービス
その他
全てのカテゴリ
閲覧履歴
二酸化セレンのメーカー12社一覧や企業ランキングを掲載中!
二酸化セレン (英: selenium dioxide) とは、セレンの酸化物の一種です。
無水亜セレン酸 (英: Selenous anhydride) とも呼ばれます。セレンの燃焼や硝酸を用いた酸化によって生成し、常温では無色の結晶です。
労働安全衛生法では、名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物に該当しています。労働基準法では疾病化学物質に、化学物質管理促進法 (PRTR 法) では第1種指定化学物質に、毒物及び劇物取締法では毒物に該当します。
社員数の規模
設立年の新しい会社
歴史のある会社
二酸化セレン (英: selenium dioxide) とは、セレンの酸化物の一種です。
無水亜セレン酸 (英: Selenous anhydride) とも呼ばれます。セレンの燃焼や硝酸を用いた酸化によって生成し、常温では無色の結晶です。
労働安全衛生法では、名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物に該当しています。労働基準法では疾病化学物質に、化学物質管理促進法 (PRTR 法) では第1種指定化学物質に、毒物及び劇物取締法では毒物に該当します。
有機化学分野で二酸化セレンは、酸化試薬の1つとして使用可能です。二酸化セレンを酸化剤に使用し、ほかの合成方法では難しい物質を容易に得られます。具体的には、カルボニル化合物、オレフィン、アセチレン類、アルコール等の酸化に利用可能です。
ガラスへの添加剤としても使用されており、ガラスに二酸化セレンを添加すると赤色を呈します。不純物を含む青色に見えるガラスを無色に見せるために、二酸化セレンを加える場合もあります。単体セレン、セレン酸塩、亜セレン酸塩も同様の用途で利用可能です。
常温で無色の針状結晶です。昇華点は315°Cで黄緑色の気体になり、封管中では融点は340°Cで青色の液体に変わります。25°Cで100gの水に、73.3g溶けます。
独特の不快臭を有し、毒性は強いです。マウスによる経口投与での50%致死量 (LD50) は23.3mg/kgで、ラットによる経口投与では68.1mg/kgです。吸入や皮膚から吸収されるため、取り扱いに注意する必要があります。
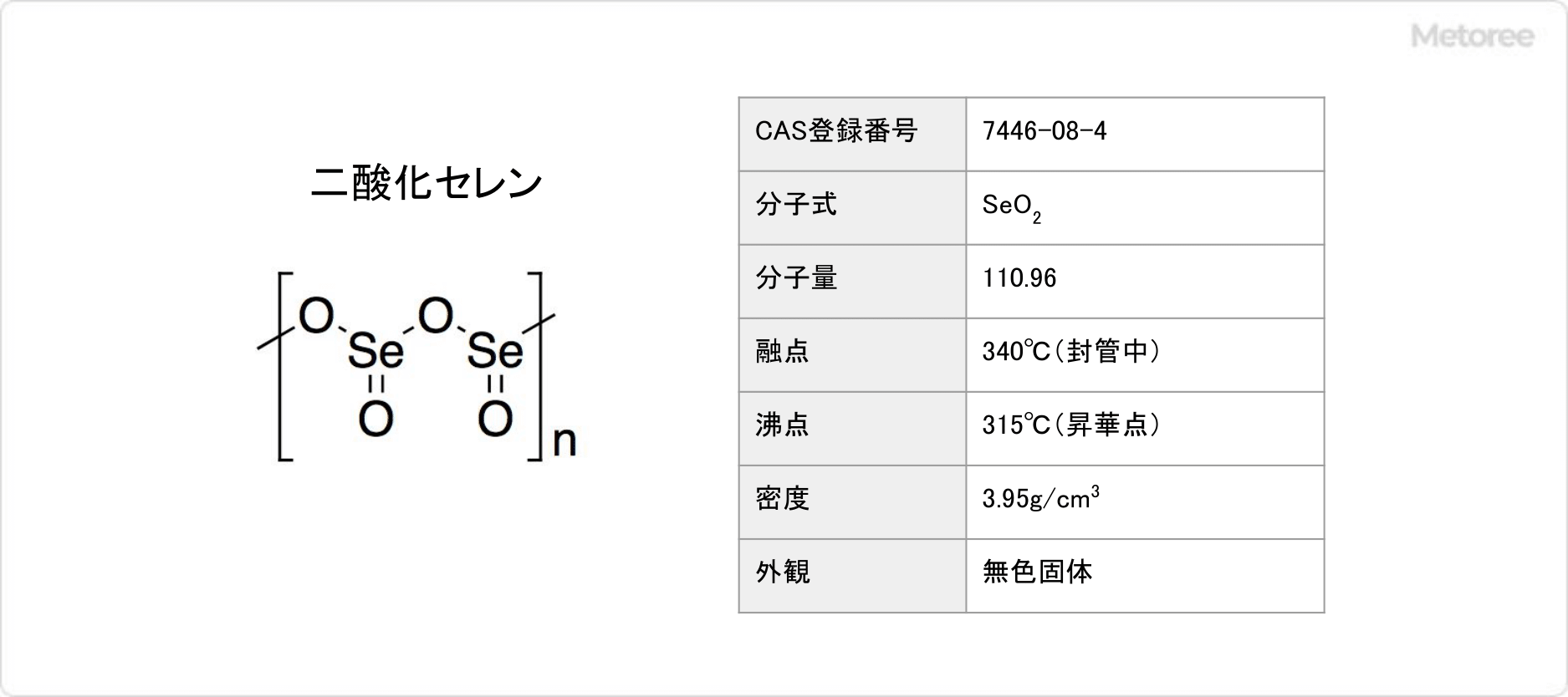
二酸化セレンの化学式はSeO2、式量は110.96g/mol、密度は3.95g/cm3です。室温では鎖状高分子を形成しています。交互にセレン原子と酸素原子が並んでおり、それぞれのセレン原子はピラミッド型を取っていて、末端にはオキシド基があります。架橋Se-Oは179pmで、末端Se-Oは162pmです。セレンの立体化学は、ポリマー鎖に沿って交互になっています。
気相で二酸化セレンは、二量体やオリゴマーとして存在し、高温では単量体になります。単量体は二酸化硫黄に似た曲がった構造を取り、結合長は161pmです。単量体は極性分子で、双極子モーメントは2.62Dで、2つの酸素原子の中点からセレン原子に向いています。二量体は中心対称のいす形を取っています。オキシ塩化セレン (英: Selenium oxydichloride) に二酸化セレンを溶かすと、三量体の[Se(O)O]3を生成可能です。
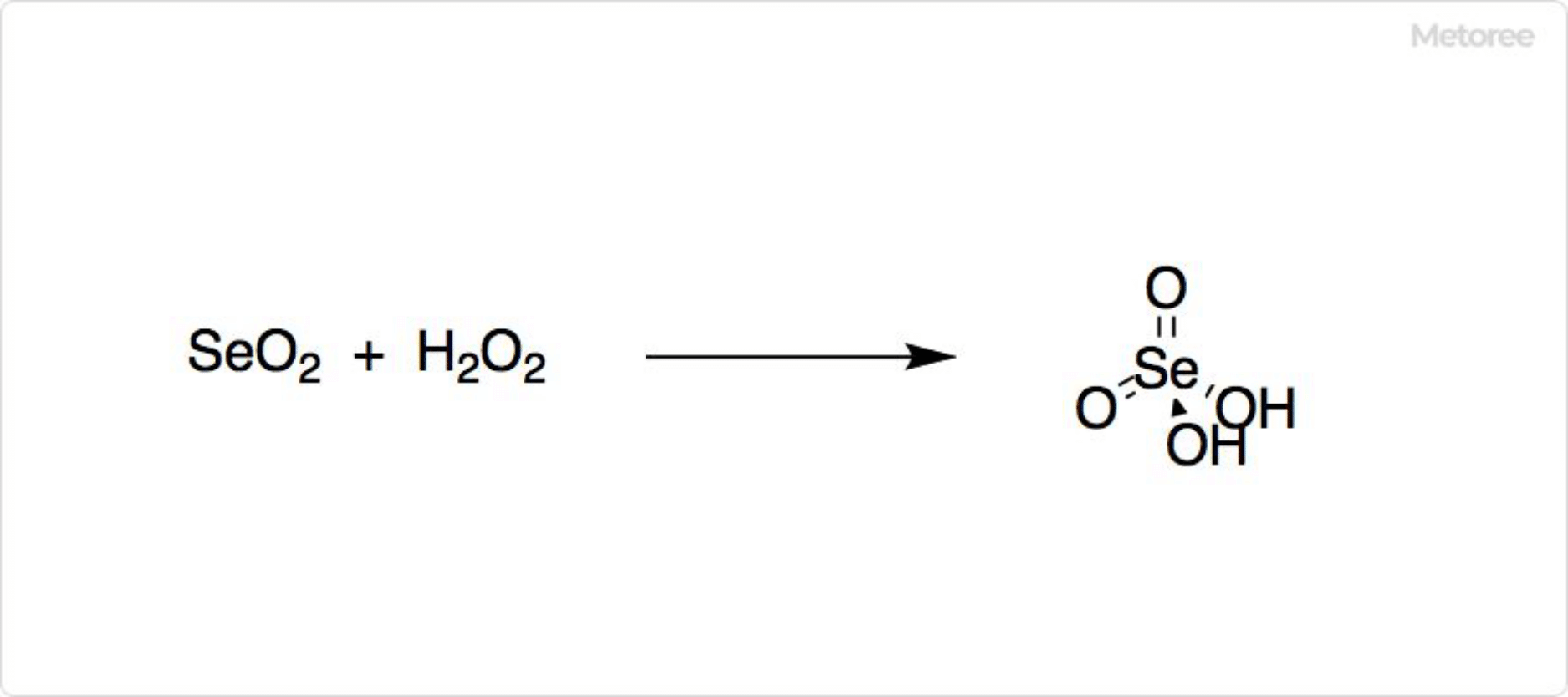
図2. 二酸化セレンの反応
二酸化セレンはアンモニアにより還元され、セレンが生じます。過酸化水素や硝酸中の酸素によって酸化すると、セレン酸を生成可能です。水との反応では亜セレン酸が得られます。
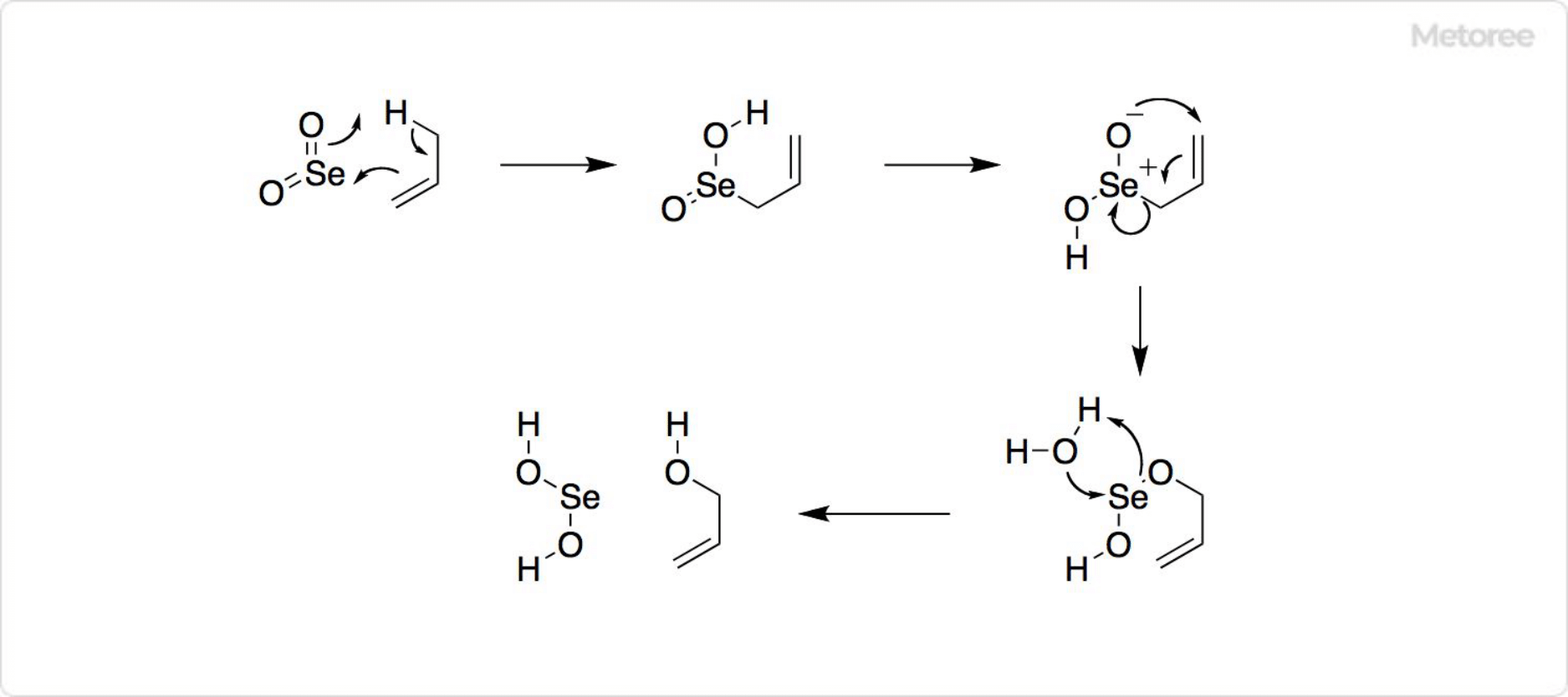
図3. 二酸化セレンを用いた反応
有機合成で二酸化セレンは重要な試薬です。アセトアルデヒドの三量体であるパラアルデヒド (英: paraldehyde) を、二酸化セレンによって酸化すると、グリオキサール (英: glyoxal) が得られます。シクロヘキサノンの酸化によって、1,2-シクロヘキサンジオン (英: 1,2-cyclohexanedione) を生成可能です。
二酸化セレンはセレンに還元され、赤色の非晶質固体として沈殿するため、容易に濾別できます。二酸化セレンを用いた酸化反応はライリー酸化 (英: Riley oxidation) と呼ばれます。
アリル基を有するアルキル化合物やアリール化合物の酸化にも使用可能です。アシル化ヒドラゾン誘導体から1,2,3-セレナジアゾール (英: 1,2,3-selenadiazoles) を合成する際にも用いられます。
参考文献
https://labchem-wako.fujifilm.com/sds/W01W0119-0035JGHEJP.pdf
https://www.jstage.jst.go.jp/article/yukigoseikyokaishi1943/30/8/30_8_739/_pdf
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7446-08-4.html