塩化ニッケルとは
塩化ニッケルとは、ニッケルの塩化物です。
GHS分類で、急性毒性 (経口) 、皮膚刺激性、呼吸器感作性、皮膚感作性、発がん性、生殖毒性、特定標的臓器毒性 (単回、反復ばく露) が認められています。無水物以外にも、一水和物や六水和物が知られています。
他のニッケル塩と同様に、発癌性物質です。塩化ニッケルの法分類は、労働安全衛生法で「名称等を表示・通知すべき危険物および有害物」に指定されています。化審法では「優先評価化学物質」、PRTR法では「特定第1種指定化学物質」に指定されています。
塩化ニッケルの使用用途
工業的に塩化ニッケルは、アンモニアガス吸収剤、ニッケルめっき、染料、電池などに用いることが可能です。錯体化学ではニッケル錯体の前駆体として、さらに有機合成で添加剤や試薬としても広く知られています。
特に大部分は、ニッケルめっきに使用されており、陽極の金属ニッケルを溶かし、さらに液の溶解度を増やす働きがあります。すなわち、めっき浴ではニッケルイオンの供給源です。
その一方で、塩化物イオンを共有する役割を持っており、塩化物イオンの腐食性で陽極のニッケルがイオンとして溶解を促進します。
塩化ニッケルの性質
塩化ニッケルは、淡黄橙色の塊状、結晶、粉末であり、吸湿性があります。融点は1,001°Cです。一般的に広く用いられる六水和物の外観は、緑~黄緑の結晶です。潮解性があり、水やアルコールによく溶けます。
2価のニッケルは不対電子を2つ有し、平面4配位のニッケル錯体は反磁性を示します。
塩化ニッケルの構造
塩化ニッケルの化学式は、NiCl2で表されます。無水塩の式量は129.59、比重は3.55であり、六水和物の式量は237.69、比重は1.92です。
結晶構造は、塩化カドミウムと同じです。それぞれのNi2+中心に6つのCl−イオンが配位し、それぞれのCl−は3つのNi2+と結合しています。Ni−Cl結合はイオン性です。
六水和物であるNiCl2•6H2Oは、水分子6つの中で4つだけがニッケルに直接結合しています。すなわち、錯体部分のtrans-[NiCl2(H2O)4]と錯体に弱く結合した水分子2つから構成される結晶構造を有します。
塩化ニッケルのその他情報
1. 塩化ニッケルの合成法
塩化ニッケルの製造方法には、金属ニッケル、酸化ニッケル、または炭酸ニッケルを塩酸に溶解して水和物を得た後、塩化水素の気流下で加熱して得る方法が知られています。
水和物は、加熱だけでは無水物になりません。緑から黄に色が変わるため、脱水が確認できます。
2. 塩化ニッケルを用いた反応
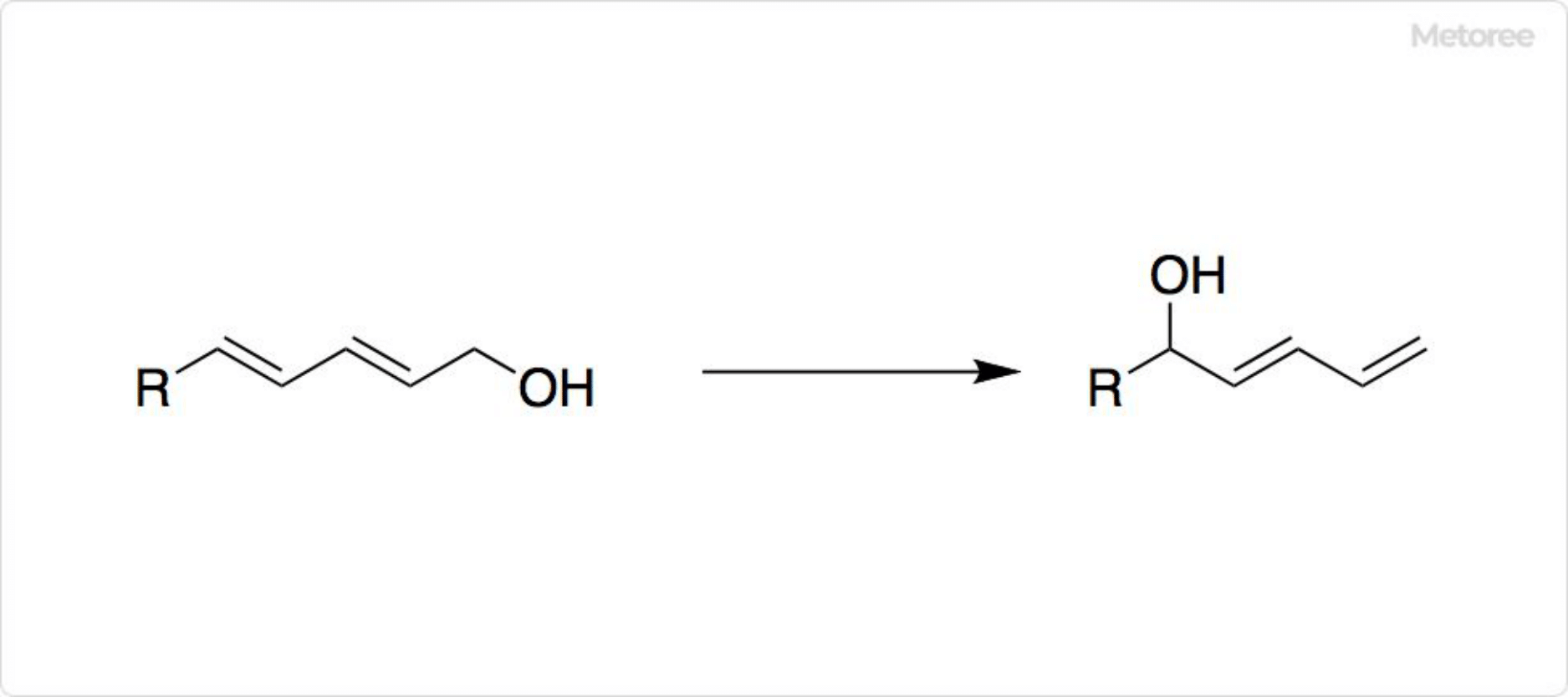
図1. 塩化ニッケルを用いた反応
塩化ニッケルや水和物は、さまざまな有機合成反応に利用可能です。例えば、弱いルイス酸として、ジエノールの位置異性化に用いられます。
塩化クロム(II) (CrCl2) と組み合わせて、ヨウ化ビニル化合物とアルデヒドからアリルアルコールを合成できます。水素化リチウムアルミニウム (LiAlH4) での還元での添加剤のほか、水素化ホウ素ナトリウム (NaBH4) の反応でのホウ化ニッケルの調製などにも使用可能です。
3. 塩化ニッケルの錯体
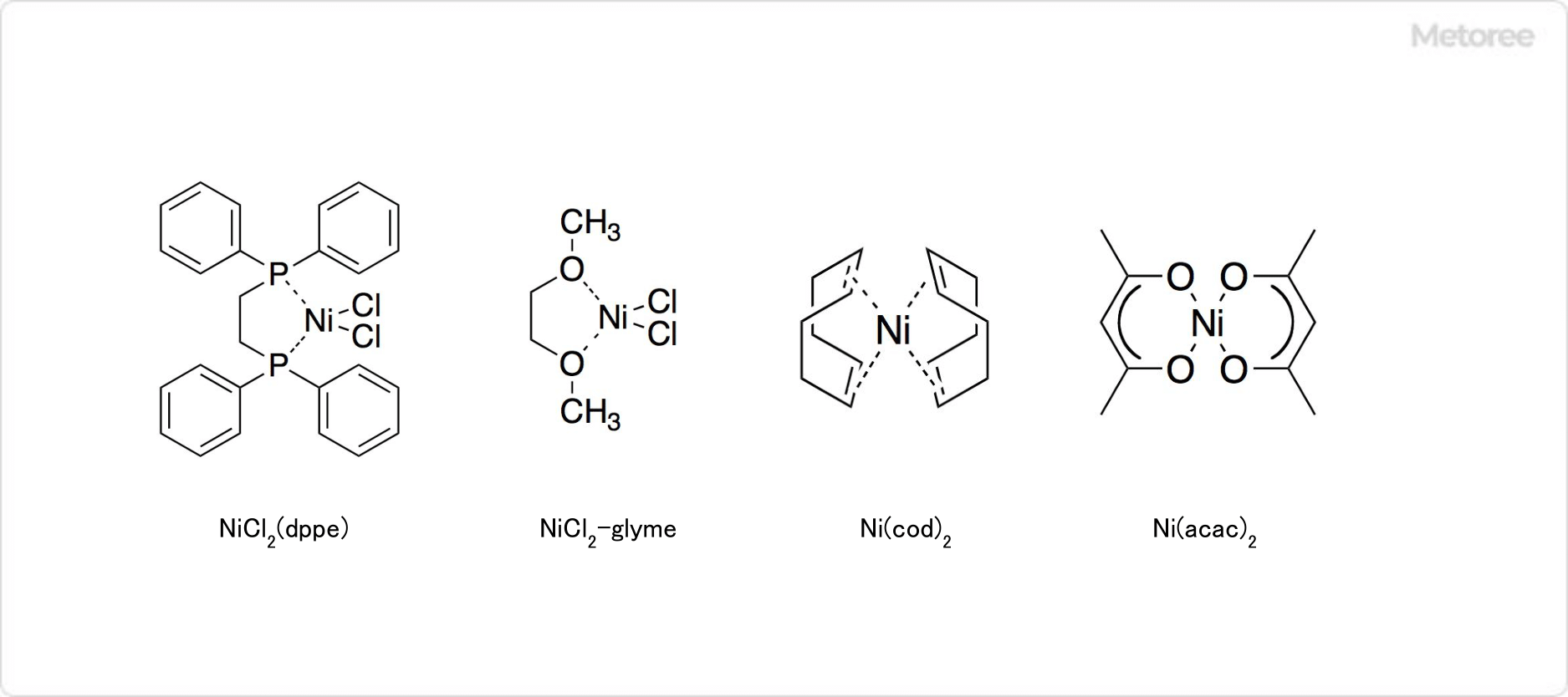
図2. 塩化ニッケルから得られる錯体
塩化ニッケル六水和物のH2Oは、容易にアンモニア、アミン、ホスフィン、チオエーテル、チオラートなどに置換されます。錯体の具体例として、紫色の八面体型の[Ni(NH3)6]Cl2、オレンジ色の平面4配位のNiCl2(Ph2PCH2CH2PPh2)、無色の平面4配位の[Ni(CN)4]2-、青色の四面体型の[NiCl4]2-などが挙げられます。
4. 塩化ニッケル錯体を用いた反応
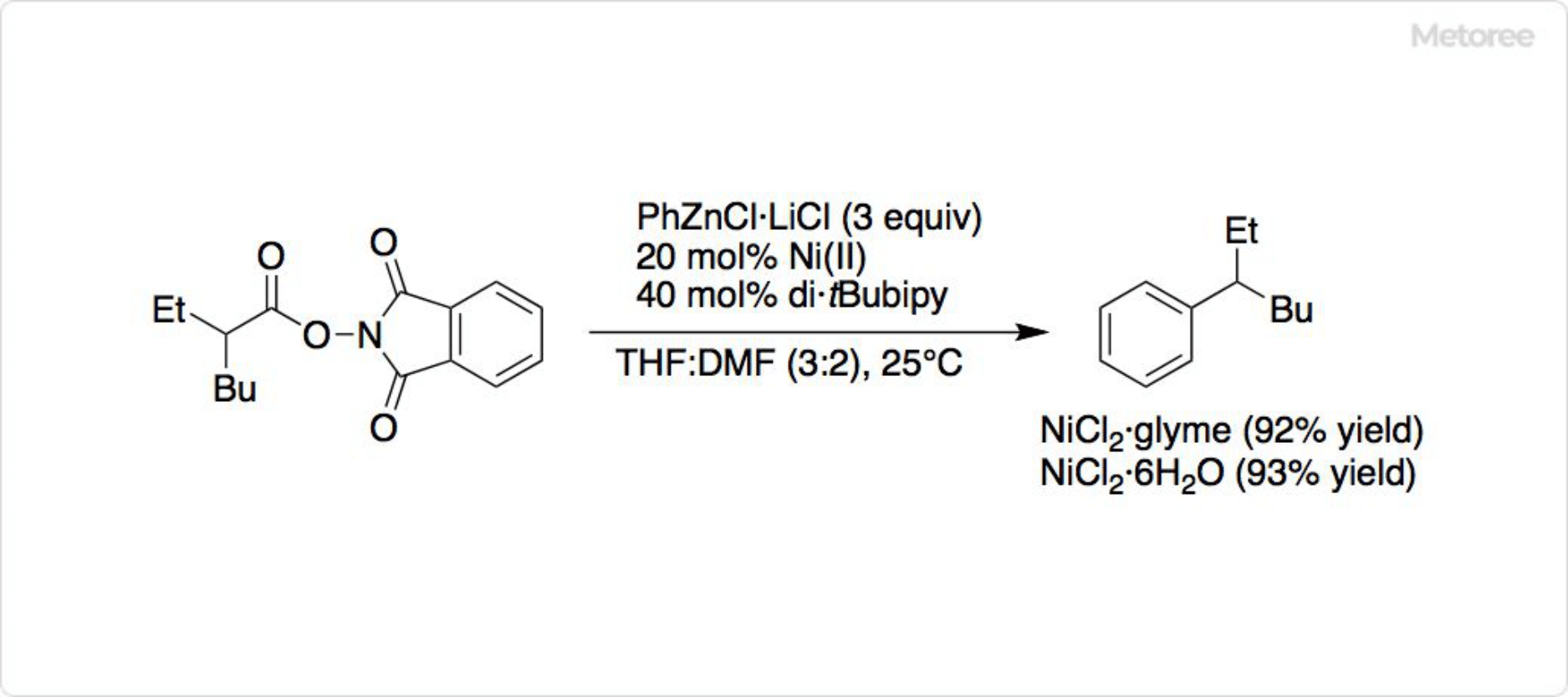
図3. 塩化ニッケル錯体を用いた反応
NiCl2-glyme錯体は、六水和物と比べて溶解しやすいため、反応に使用されます。そのほか、ビス(1,5-シクロオクタジエン)ニッケル (Ni(cod)2) は多種多様な用途があります。塩化ニッケルから、Ni(cod)2の前駆体であるニッケル(II)アセチルアセトナート (Ni(acac)2) が合成可能です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7718-54-9.html