塩化チオニルとは
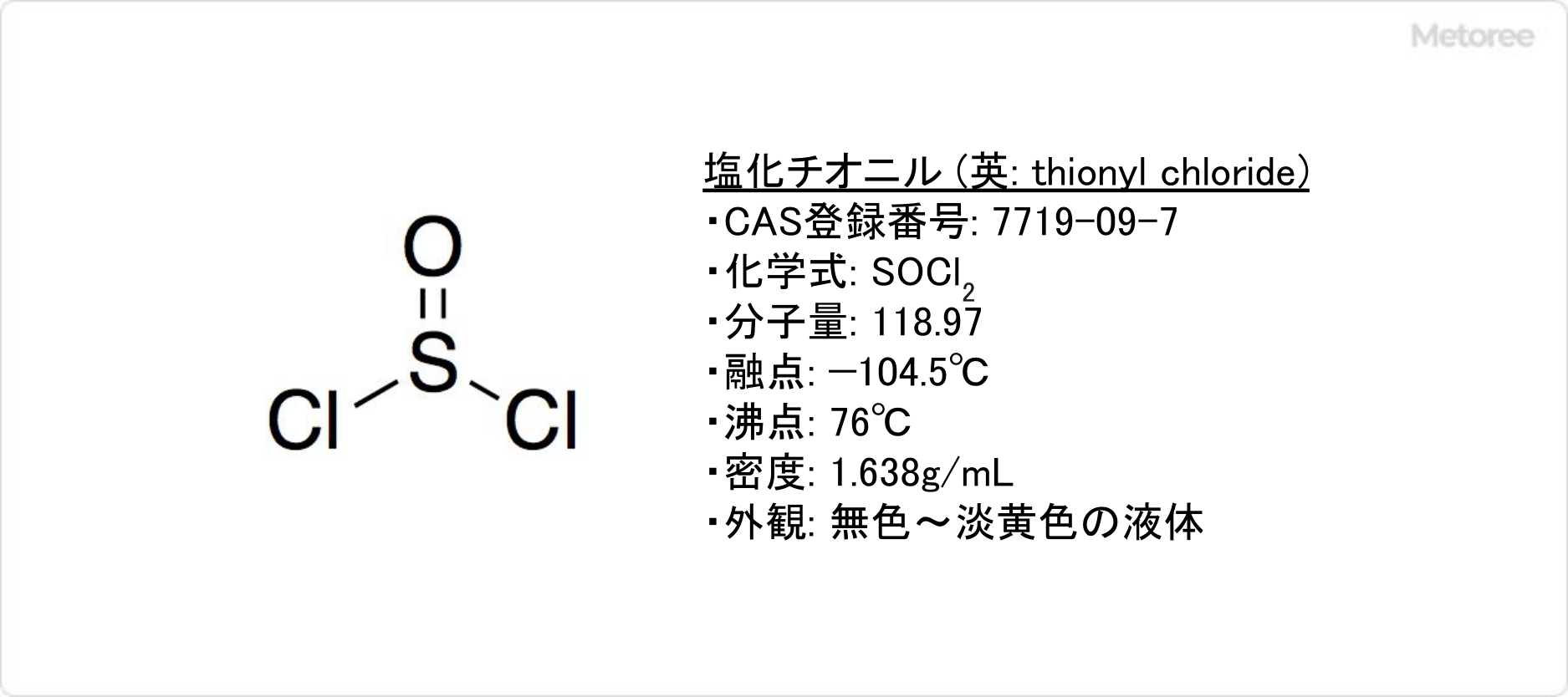
図1. 塩化チオニルの基本情報
塩化チオニルとは、発煙性をもった刺激臭のある無色の液体です。
別名、塩化スルフォニル (英: sulfinyl chloride) やチオニルクロリド (英: thionyl chloride) とも呼ばれます。液体や蒸気の塩化チオニルは皮膚や粘膜を侵すため、有毒な物質です。
塩化チオニルは、毒物及び劇物取締法にて「劇物」に、労働安全衛生法にて「名称等を表示すべき危険物及び有害物」「名称等を通知すべき危険物及び有害物」にそれぞれ指定されており、取り扱いには注意が必要です。
塩化チオニルの使用用途
塩化チオニルは、染料・医療・農薬などの有機合成において、水酸基やメルカプト基を塩素原子で置換する際に用いられています。また、グリニャール試薬と反応させ、スルホン基を導入するのにも、塩化チオニルが使用可能です。その他、無水の金属ハロゲン化物を得るための脱水剤としても使用されています。
液体状の塩化チオニルは、塩化チオニルリチウム電池の正極活物質として重宝されています。塩化チオニルリチウム電池は、メモリICのバックアップ用をはじめ、エレクトロニクス機器電源、電力、ガス、水道メーター用電源などに広く利用されています。
塩化チオニルの性質
塩化チオニルには発煙性や刺激臭があり、融点は–104.5℃、沸点は76℃です。140℃以上に加熱すると分解し始めて、完全に分解するのは500℃です。塩化チオニルの分解によって、二酸化硫黄 (SO2) 、二塩化二硫黄 (S2Cl2) 、塩素 (Cl2) が生成します。
塩化チオニルはベンゼンやクロロホルム等の溶媒と混合します。また、水と激しく発熱しながら反応して、塩化水素 (HCl) と二酸化硫黄 (SO2) を生じます。
塩化チオニルの構造
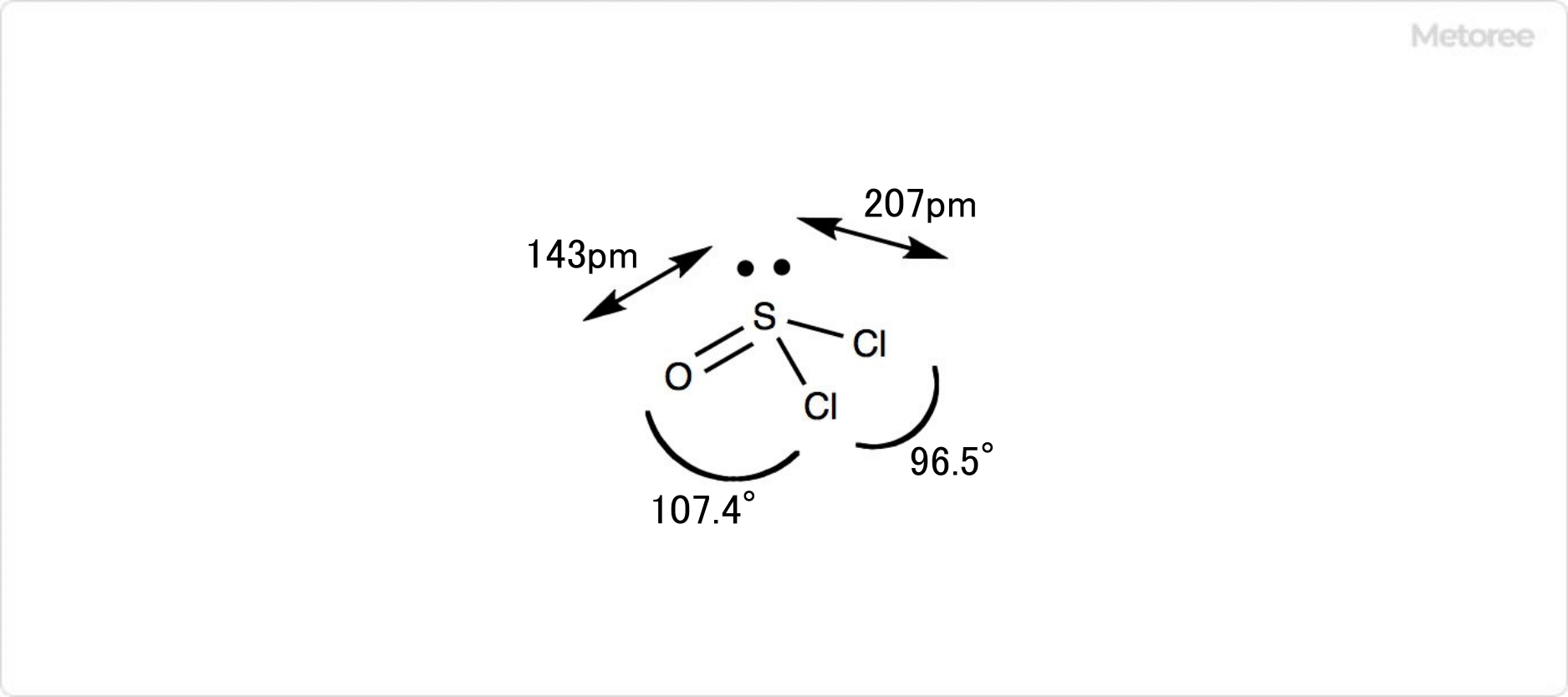
図2. 塩化チオニルの詳細な構造
塩化チオニルは亜硫酸の酸塩化物のような化合物であり、化学式はSOCl2、分子量は118.97で、比重が1.65g/cm3の液体です。硫黄-酸素結合 (S-O) はおよそ143pmで、硫黄-塩素結合 (S-Cl) の長さはおよそ207pmです。
塩化チオニルの分子は三角錐形を取っています。∠O-S-Clと∠Cl-S-Clは、それぞれ107.4°と96.5°です。
塩化チオニルのその他情報
1. 塩化チオニルの合成法
塩化チオニルは、五塩化リン (PCl5) と二酸化硫黄 (SO2) の反応によって生じる塩化ホスホリル (POCl3) を蒸留で分離することにより得られます。また、三酸化硫黄 (SO3) と二塩化硫黄 (SCl2) の反応でも、塩化チオニルが生成可能です。
三酸化硫黄の代わりに、発煙硫酸 (英: Oleum) やクロロスルホン酸 (ClSO3H) で酸化しても製造できます。塩化アンチモンなどの触媒を使用すると反応しやすいです。
さらに、活性炭触媒を用いて二酸化硫黄 (SO2) と四塩化硫黄 (SCl4) の混合物を反応させて生成物を蒸留しても、塩化チオニルを得られます。
2. 塩化チオニルの反応
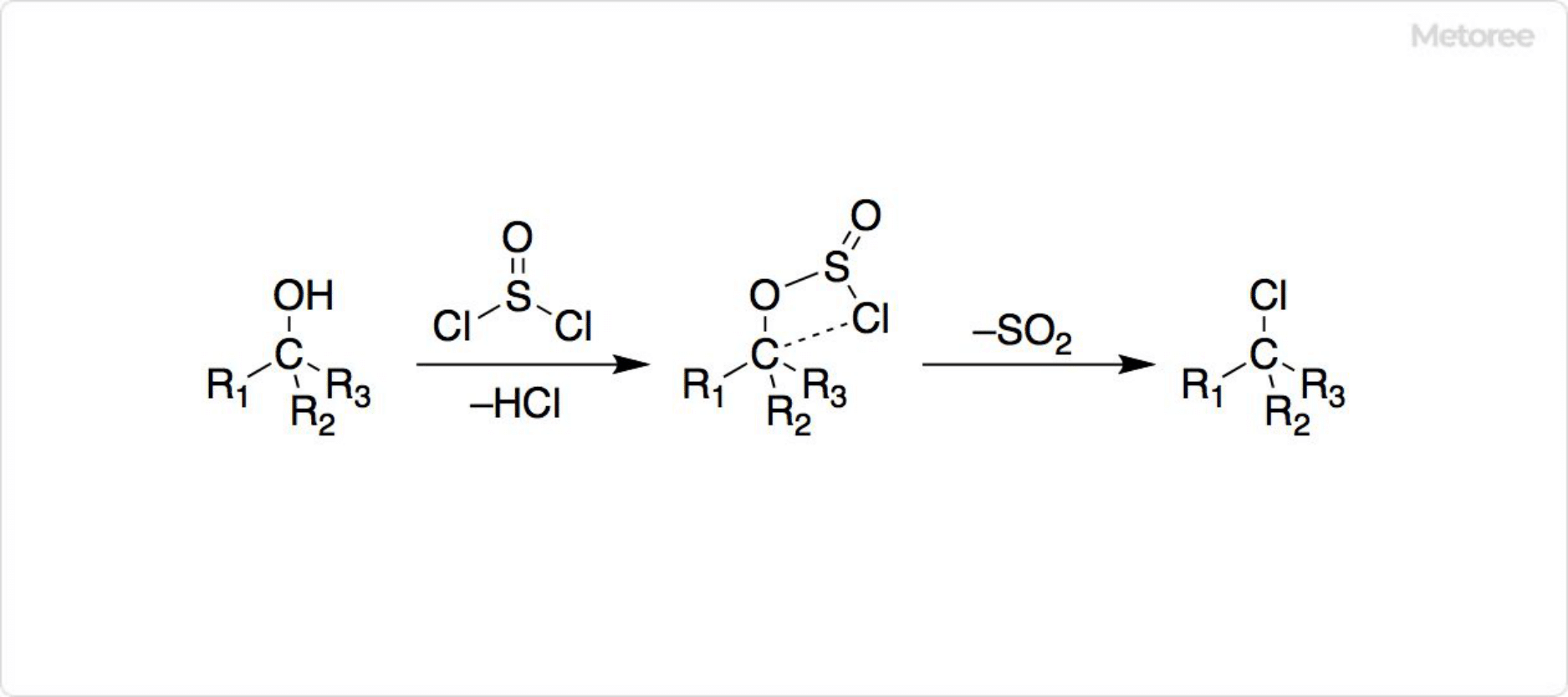
図3. 塩化チオニルとアルコールの反応
カルボン酸やアルコールの塩素化に、塩化チオニルがよく用いられています。他のハロゲン化剤とは異なり、反応による生成物がHClやSO2のようなガスであり、塩化チオニルが低沸点なので、反応系から除去することが容易です。
それに加えて塩化チオニルを用いたアルコールの塩素化は、他の塩素化剤のようにSN1反応やSN2反応では進行しません。したがって、ワルデン反転 (英: Walden inversion) することなく、反応が立体保持で起こります。反応機構として、四員環遷移状態が提唱されており、SNi機構と呼ばれています。
3. 塩化チオニルの保管
容器を密閉し、湿気や直射日光を避け、換気の良い冷暗所に保管することが推奨されています。水分に触れると加水分解が起こり、激しく反応すると塩酸が生成します。