¿Qué es el Ácido Nitroso?
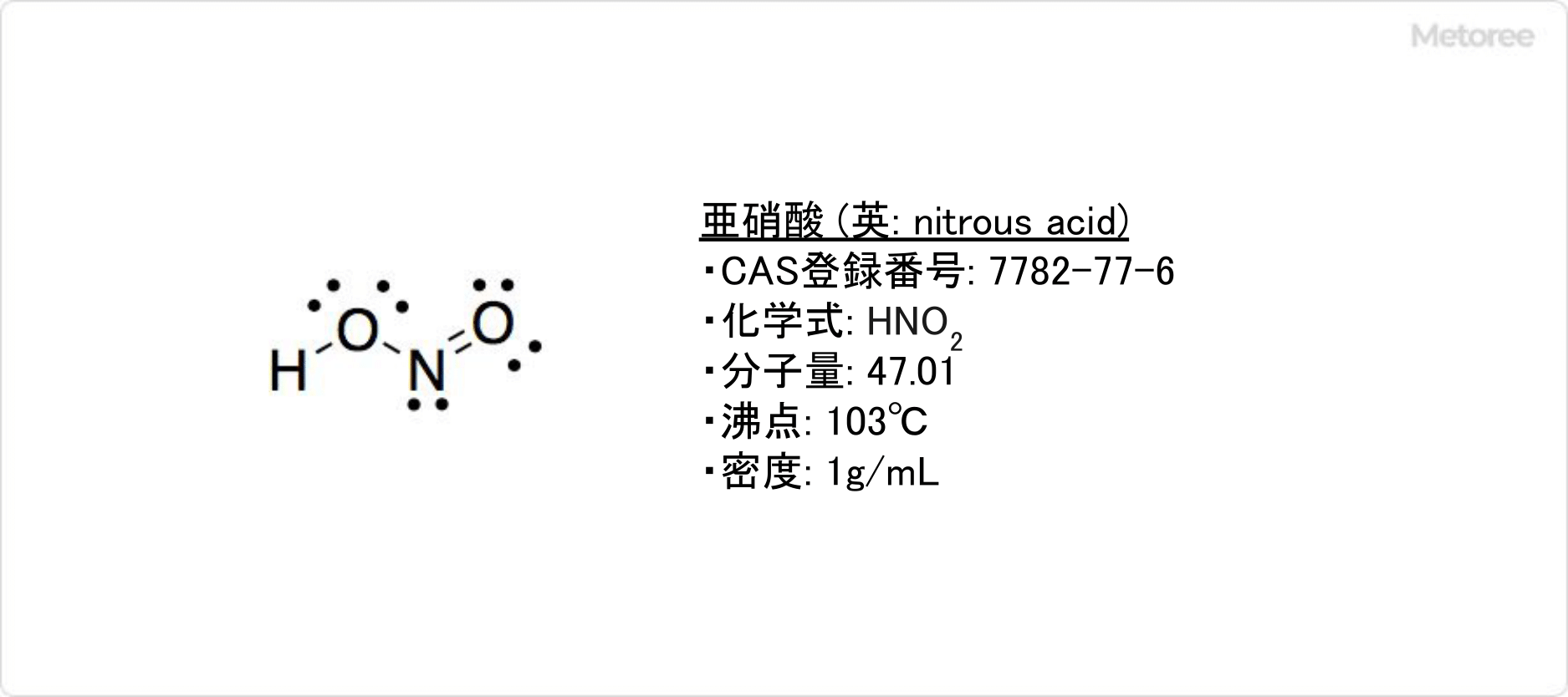
- Número de registro CAS:7782-77-6
- Fórmula química:HNO2
- Peso molecular:47.01
- Punto de ebullición:103℃
- Densidad:1g/cm3
El ácido nitroso es un ácido débil de color azul pálido que producen óxido nítrico y ácido nítrico cuando se calientan.
Sólo está presente en solución acuosa y en forma de vapor. Tiene una densidad de 1 g/cm3 y un punto de ebullición de 103 °C. El ácido nitroso se obtiene como solución acuosa haciendo reaccionar nitrito de bario con ácido sulfúrico diluido o nitrito de plata con ácido clorhídrico en una solución acuosa a baja temperatura y filtrando el precipitado.
El ácido nitroso también se producen disolviendo una mezcla de monóxido de nitrógeno y dióxido de nitrógeno en agua helada.
Usos del Ácido Nitroso
El ácido nitroso tiene varias aplicaciones importantes en la industria química y alimentaria. Se utilizan, por ejemplo, en la síntesis de sales de diazonio mediante su reacción con aminas orgánicas. Estas sales de diazonio actúan como productos intermedios esenciales en la síntesis de una amplia variedad de compuestos aromáticos.
Además, el ácido nitroso también puede emplearse para la producción de ésteres estables cuando se combinan con alcoholes. Algunos de los ésteres alquílicos resultantes encuentran aplicaciones en la industria farmacéutica, donde se utilizan, por ejemplo, como vasodilatadores.
El ácido nitroso, en particular, se utiliza en varias áreas, incluyendo su uso como vasodilatador y como antídoto contra el cianuro, entre otros.
En la industria alimentaria, los nitritos, como el nitrito de sodio, se utilizan como aditivos en productos cárnicos procesados. También tienen un papel importante como sustancias inhibidoras del botulismo, una bacteria potencialmente peligrosa en alimentos envasados. El ácido nitroso a menudo se utiliza como aditivos alimentarios para realzar el color de ciertos productos, como las salchichas, al coordinarse con el hierro hemo presente en la carne y proporcionar un color rojo brillante.
Propiedades del Ácido Nitroso
El ácido nitroso es un ácido débil, con una constante de disociación en solución acuosa diluida de pKa = 3,3, que es unos 105 menos que la del ácido nítrico. En estado ácido libre, es inestable y se descompone fácilmente, y en agua se descompone inmediatamente en óxido de nitrógeno y ácido nítrico.
Por ello, se almacena en forma de ácido nitroso o ésteres de nitrito. Son muy reactivos y poseen propiedades oxidantes y reductoras. Los agentes oxidantes fuertes lo oxidan a ácido nítrico.
El yoduro lo reduce a óxido nítrico, el dióxido de azufre a hidroxilamina y el zinc a amoníaco. El potencial redox estándar como agente oxidante es E° = 0,996 V y como agente reductor E° = 1,093 V.
Estructura del Ácido Nitroso
El ácido nitroso del sistema de nomenclatura IUPAC para el ácido dioxonítrico(III). Es uno de los oxoácidos del nitrógeno, con fórmula química HNO2 y masa molar de 47,01.
La molécula gaseosa del ácido nitroso tiene una estructura de tipo H-O-N-O. ∠Los ángulos H-O-N y O-N-O son de 102° y 111° respectivamente. Está disponible tanto en forma cis como trans, siendo la forma trans más estable.
Más Información sobre el Ácido Nitroso
1. Diazotización por Ácido Nitroso
Cuando el ácido nitroso reacciona con aminas secundarias, forma nitrosaminas; cuando reacciona con aminas primarias aromáticas, la deshidratación da iones diazonio aromáticos. Los compuestos de diazonio son compuestos orgánicos nitrogenados que contienen -N+≡N en sus moléculas.
El sustituyente monovalente monocatiónico se denomina grupo diazonio, el catión expresado como R-N+≡N se denomina ion diazonio, y las sales que contienen iones diazonio se denominan sales de diazonio. Los iones diazonio son muy reactivos.
Los iones diazonio se utilizan en reacciones de sustitución por la reacción de Sandmeyer y en la síntesis de compuestos azoicos por acoplamiento diazoico. Muchos compuestos azoicos son colorantes, por lo que resultan útiles en la síntesis de colorantes. 2. Compuestos relacionados con el nitrito
2. Ácido Nitroso
Los iones ácido nitroso pueden coordinarse con diversos metales. Los complejos coordinados con nitrógeno se denominan complejos nitro y los coordinados con oxígeno, complejos nitrito.
Los nitritos típicos son el nitrito de potasio (KNO2), el nitrito de calcio (Ca(NO2)2), el nitrito de plata (AgNO2), el nitrito de sodio (NaNO2) y el nitrito de bario (Ba(NO2)2).