硫酸亜鉛とは
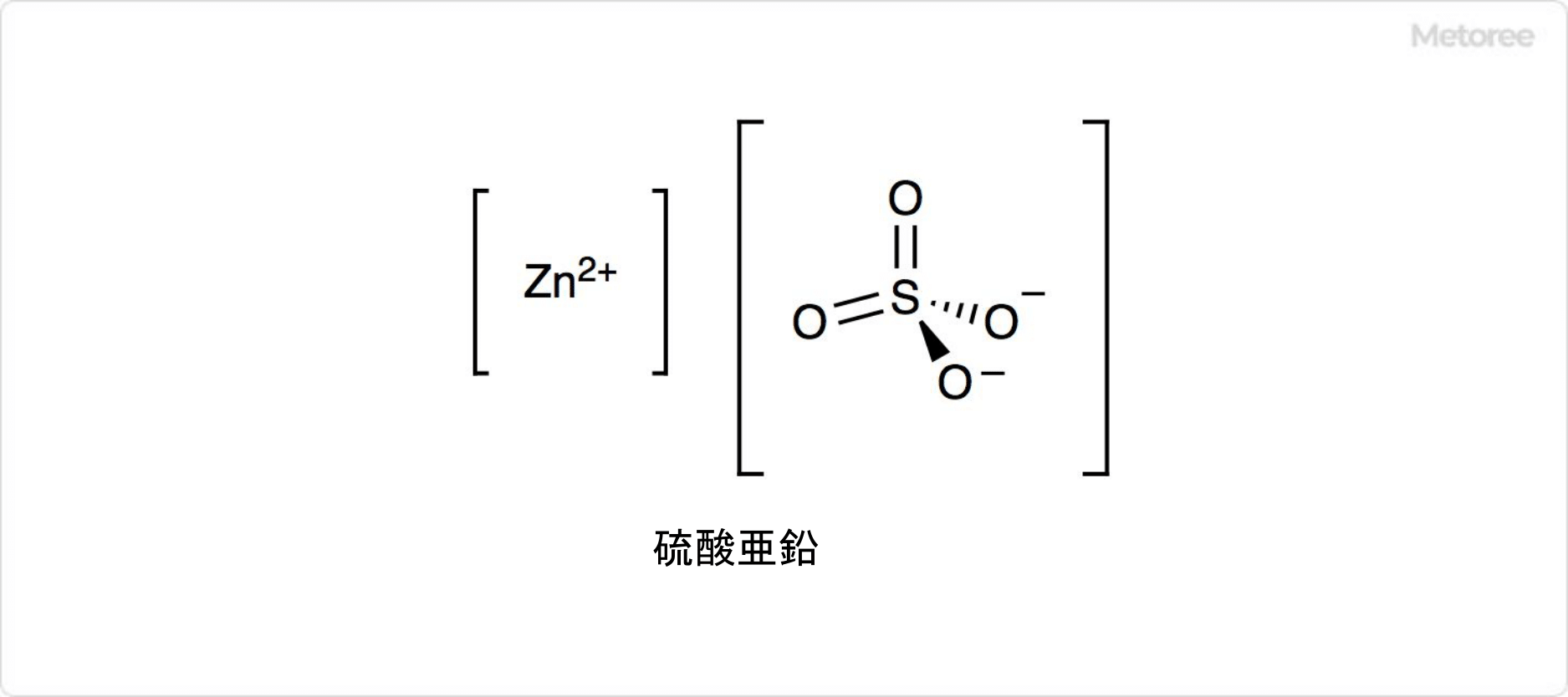
硫酸亜鉛とは、硫酸と亜鉛を反応させて生成する無機化合物です。
化学式はZnSO4で表されます。水溶液を結晶化させると、温度により1、6、7水和物を生成可能です。
硫酸亜鉛の粉末は眼に対して刺激性があり、「毒物及び劇物取締法」で劇物に指定されており、加熱によって有毒な煙霧や蒸気が発生する恐れがあります。硫酸亜鉛溶液の場合には、アルカリ性物質との混合や接触を避ける必要があります。
硫酸亜鉛の使用用途
硫酸亜鉛は、医薬用、農業用、工業用製品の原料の一つとして幅広く利用されています。
医薬用では、硫酸亜鉛の収斂性や防腐性などを活かして、結膜炎や眼瞼炎の治療用点眼薬の原料に使用されます。工業用では、レーヨンの製造過程で液体のレーヨンの凝固に使用されたり、木材の防腐剤や紙の漂白剤に利用可能です。農業用では、ミネラル分を強化する目的で飼料に添加したり、農作物への薬害を防止する目的で農業用殺菌剤の一つであるボルドー液へ混合されています。
条件付きで硫酸亜鉛は、食品添加物にも使用可能です。必須亜鉛源として動物飼料に添加されており、飼料1kgあたり最大数百mg含まれています。微量の摂取では安全だと考えられています。ただし、体重1kgあたり2~8mgの過剰摂取では、吐き気や嘔吐を伴った胃の不快感を引き起こすため、注意が必要です。
硫酸亜鉛の性質
硫酸亜鉛の1水和物は無色の粉末で、15°Cでの比重は3.28です。6水和物は無色の単斜晶系結晶で、15°Cでの比重は2.072です。2水和物や4水和物も知られています。
7水和物は無色無臭で、収斂性がある結晶です。空気中で風解し、急に加熱するとおよそ50°Cで結晶水に溶けます。穏やかに加熱すると39°Cで6水和物に、70°Cで一水和物になり、240~280°Cで無水和物に変わります。7水和物は水には溶けやすく、エタノールにはほとんど溶けません。水溶液は加水分解によって弱酸性を示します。
硫酸亜鉛の無水和物は、600°CでZn3O(SO4)2になり、930°Cで酸化亜鉛 (ZnO) に分解します。
硫酸亜鉛の構造
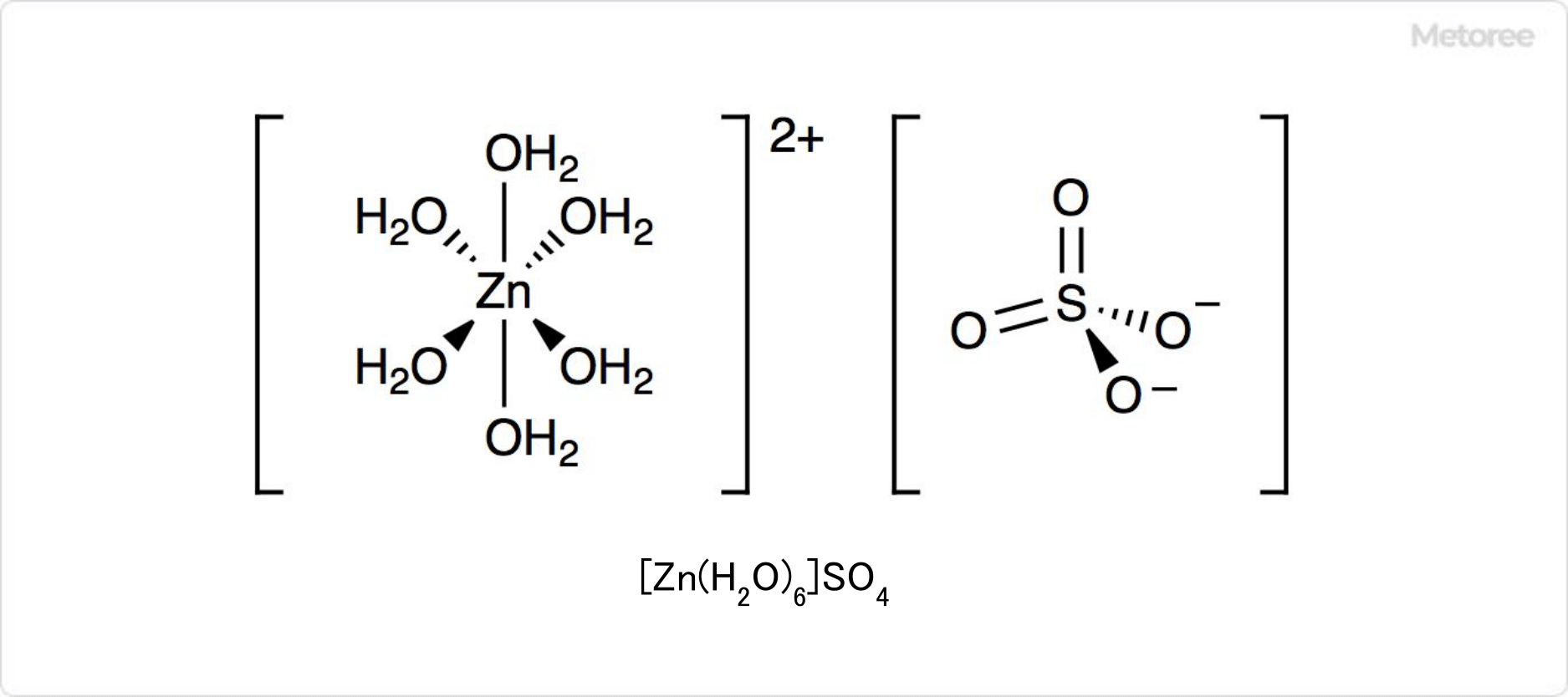
図2. 水溶液中の硫酸亜鉛
硫酸亜鉛は亜鉛含有物質を硫酸で処理すると生成します。医薬品グレードの硫酸亜鉛は、高純度の酸化亜鉛を硫酸で処理して合成可能です。
水溶液中で硫酸亜鉛の水和物は、すべて[Zn(H2O)6]2+とSO42-で構成されています。配位子として水のみを持ち、亜鉛イオンを含む配位化合物です。この溶液をバリウムイオンを含む溶液で処理すると、硫酸バリウムが生成します。
硫酸亜鉛のその他情報
1. 天然の硫酸亜鉛
ZnSO4・7H2Oは鉱物であるゴスラライト (英: goslarite) として存在します。(Zn, Cu, Fe)SO4・7H2Oなどは、微量鉱物として亜鉛緑礬に含まれています。(Zn, Fe)SO4・6H2O (ビアンキ石) 、(Zn, Mg)SO4・4H2O (ボイル石) 、(Zn, Mn)SO4・H2O (ガニング石) などの硫酸亜鉛の低水和物は、自然界ではあまり見られません。
2. 硫酸亜鉛の関連化合物
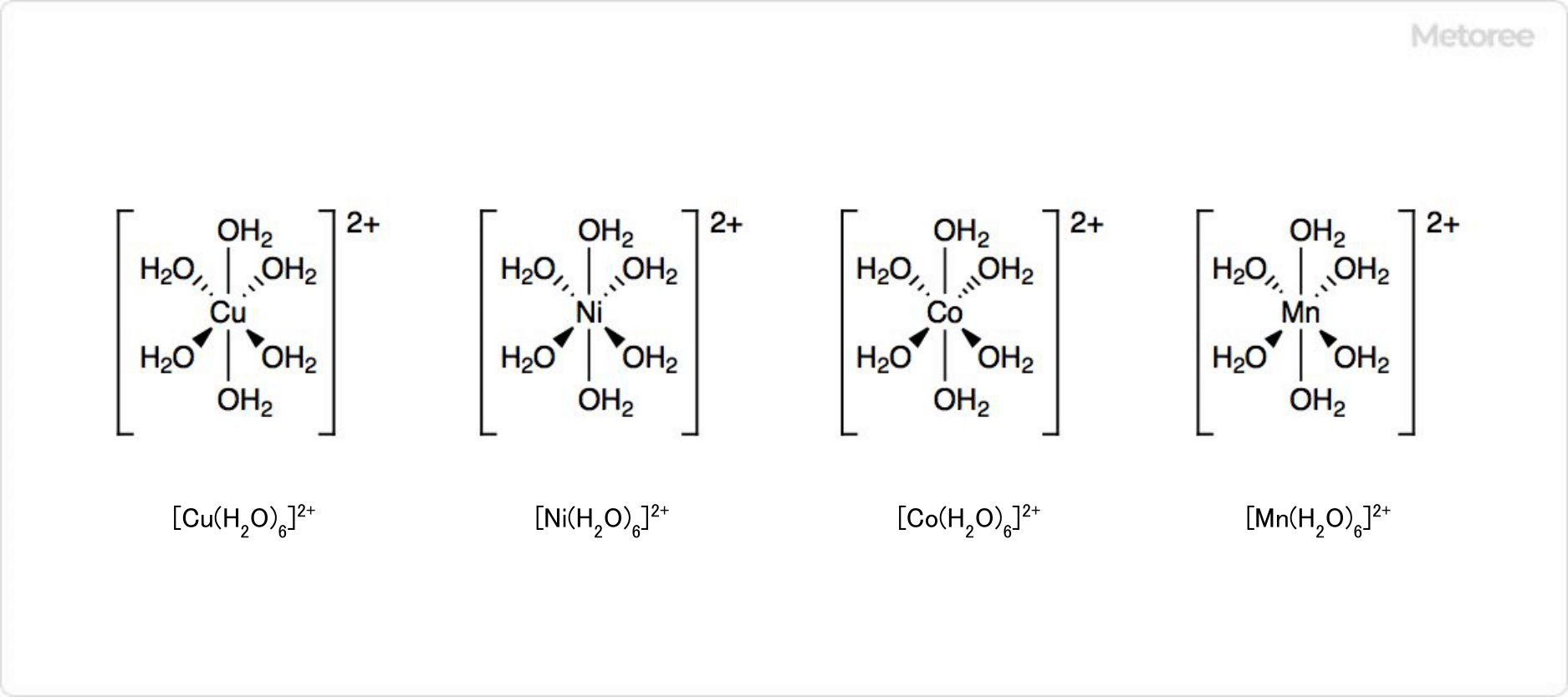
図3. 硫酸亜鉛の関連化合物
硫酸亜鉛の7水和物は斜方晶系で、硫酸第一鉄7水和物や硫酸マグネシウム7水和物と同じ構造です。a = 11.779Å,b = 12.050Å,c = 6.822Åです。6個のH2O分子が亜鉛に配位し、1個のH2O分子が硫酸イオンの酸素に配位しています。
ほとんどの金属アクア錯体は単核です。一般式は[M(H2O)6]n+ (n = 2、3) と表され、八面体構造を形成しています。具体例は、[Cu(H2O)6]2+、[Ni(H2O)6]2+、[Co(H2O)6]2+、[Mn(H2O)6]2+などです。水分子はルイス塩基として機能し、電子対を金属イオンに供与しています。