アセチルアセトンとは
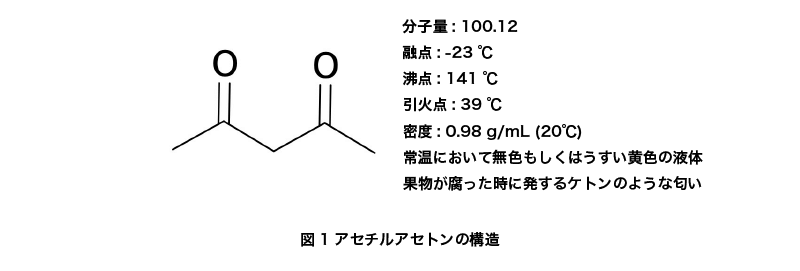
アセチルアセトン (Acetylacetone) とは、常温で無色または淡い黄色の液体として存在する有機化合物の一種です。
示性式CH3COCH2COCH3で表されます。IUPAC命名法では、2,4-ペンタンジオン (Pentane-2,4-dione) で1,3-ジケトンに分類されています。
アセチルアセトンは、金属錯体の形成をはじめとする多くの化学反応に関与し、さまざまな用途で活用されています。金属イオンの抽出剤、触媒、添加剤としての利用に加え、太陽電池や有機合成の分野でも重要な役割を担っています。
アセチルアセトンの使用用途
アセチルアセトンは、金属イオンの抽出剤として広く利用されています。その理由は、アセチルアセトンの共役塩基であるアセチルアセトナート (acac) が、2つの酸素原子を介して多くの遷移金属イオンと六員環結合を形成する能力にあります。
アセチルアセトンの金属錯体は、多岐にわたる分野で応用されています。触媒や反応試薬の前駆体、NMRシフト試薬、遷移金属触媒、有機合成触媒として利用されるほか、工業的にはヒドロホルミル化触媒の前駆体としても重要な役割を果たしています。
さらに、アセチルアセトンはガソリンや潤滑油の添加剤としても知られており、特定の化学反応において重要な役割を担っています。近年では、色素増感型太陽電池の開発において、酸化チタン (TiO2) にアセチルアセトンを添加することで性能が向上することが報告され、その応用範囲はさらに広がっています。
アセチルアセトンの原理
アセチルアセトンの原理を性質や合成方法、化学反応の観点から解説します。
1. アセチルアセトンの性質
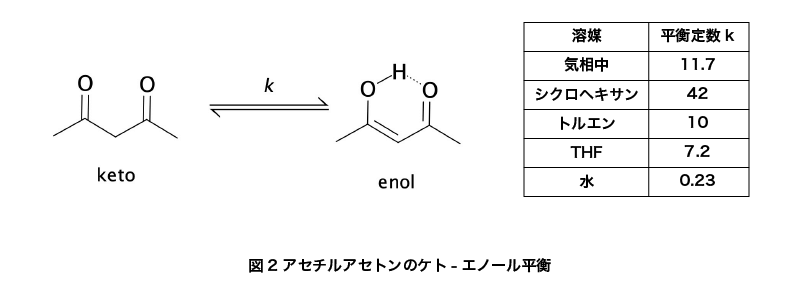
アセチルアセトンの分子量は100.12、融点は-23℃、沸点は約141℃、引火点は39℃です。密度は0.98 g/mLで、常温では無色透明の液体として存在します。この化合物は1,3-ジケトンであり、ケト-エノール平衡状態を取ります。特にエノール体はC2v対称分子として存在し、エノールの水素原子が2つの酸素の中間に位置することで安定化されています。この性質は、マイクロ波分光法によって確認されています。
また、果物が腐った際に感じられるケトン臭を発し、水にも比較的よく溶けます (溶解度16 g/100 mL) 。加えて、エタノールやジエチルエーテルなどの有機溶媒にも容易に溶解する性質を持っています。CAS登録番号は123-54-6です。
安全性に関しては、安全衛生法によって「名称等を表示すべき危険有害物」に指定されています。また、消防法では第4類 第2石油類 (非水溶性液体) に分類されるため、取り扱いには注意が必要です。
2. アセチルアセトンの合成方法
アセチルアセトンは工業的に、酢酸イソプロペニルの熱転位によって製造されます。また、実験室では以下の方法で合成が可能です。これらの方法を用いることで、アセチルアセトンを効率的に合成できます。
- 三フッ化ホウ素を触媒として用い、アセトンと無水酢酸を反応させる方法
- アセトンと酢酸エチルをアルカリ触媒により縮合させ、生成物をプロトン化する方法
3. アセチルアセトンの化学反応
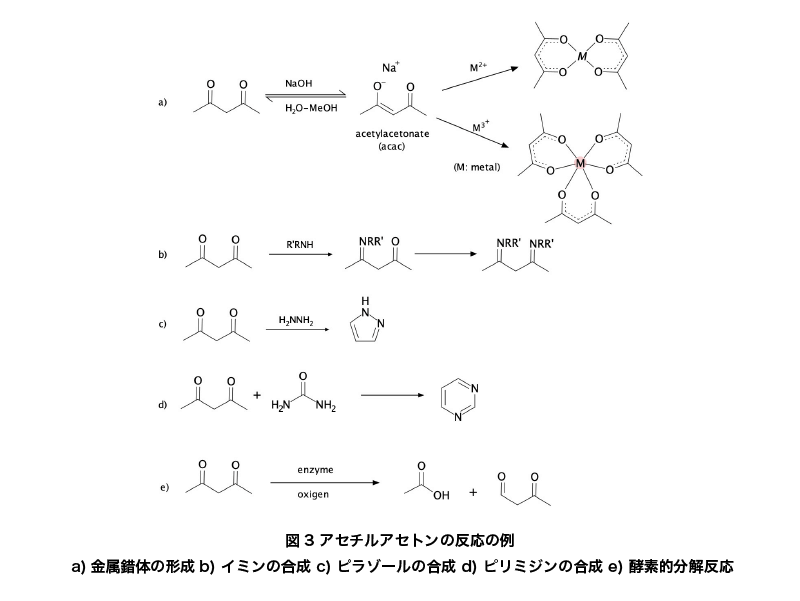
アセチルアセトンの共役塩基 (acac) は、さまざまな金属錯体を形成します。代表的な錯体として以下のものが挙げられます。
- Mn (acac)3
- VO (acac)2
- Cu (acac)2
- Fe (acac)3
- Co (acac)3
例えば、Mn(acac)3はフェノール類の酸化的カップリング反応に使用される1電子酸化剤として知られています。
アセチルアセトンは、そのカルボニル基を利用してアミンと縮合し、モノまたはジケトイミンを形成します。また、ヒドラジンと反応することでピラゾールを、尿素と反応することでピリミジンを合成することができます。アセチルアセトンは、酵素アセチルアセトンジオキシゲナーゼの作用によって炭素-炭素結合が切断されます。この反応により、酢酸と2-オキソプロパナールが生成されます。
アセチルアセトンの種類
アセチルアセトンは、実験室用の化学試薬として市販されており、一般的な容量は25 mL、100 mL、500 mLなどです。通常、常温保存が可能ですが、光による分解を防ぐため暗所に保管することが推奨されます。
また、アセチルアセトンの金属錯体 (Al, Cr, Co, VO, Cu, Fe, Ni, Zn, Zr, Sn, Ti, Inなど) は、実験室用の小規模スケールから工業用途の5 kg、10 kgスケールまで、さまざまな形態で販売されています。