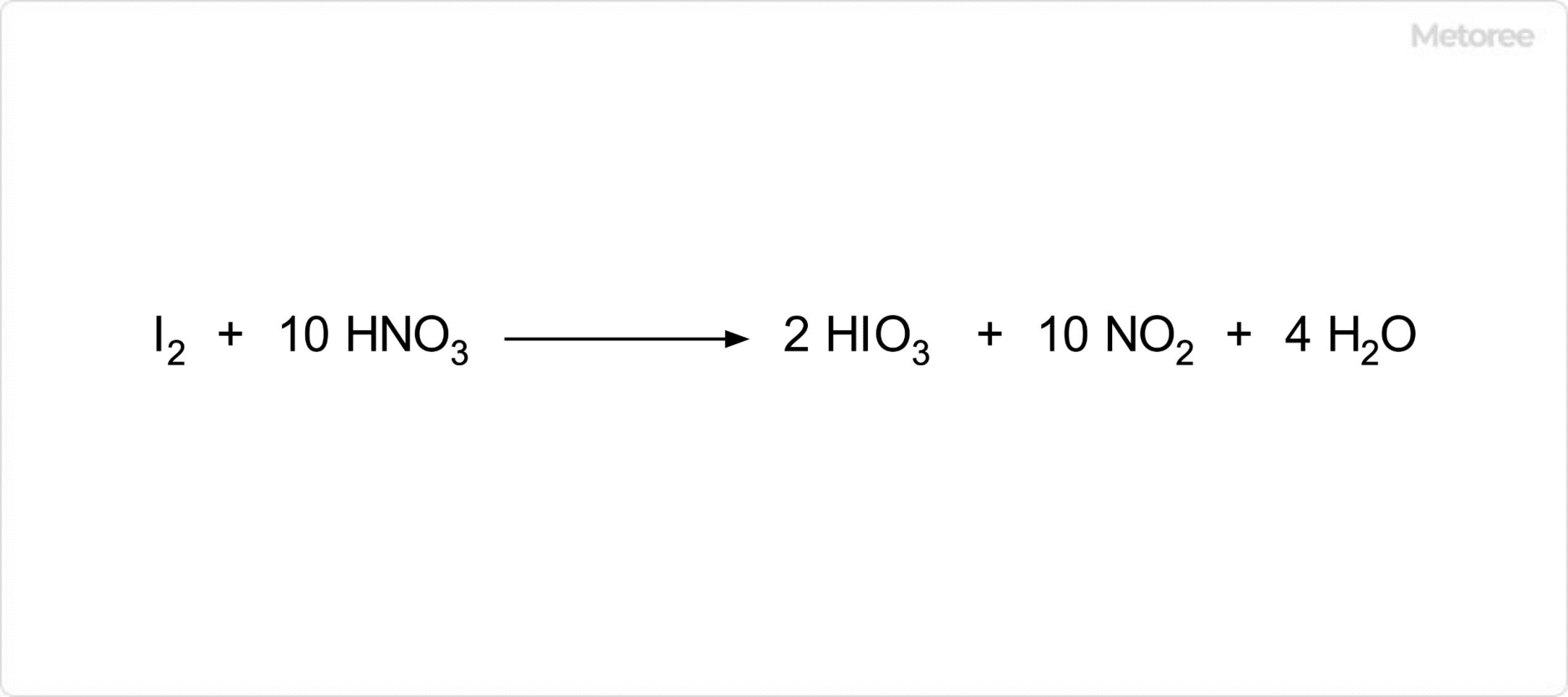三酸化ヒ素とは
三酸化ヒ素 (英: Arsenic trioxide) とは、ヒ素の酸化物で、化学式As2O3で表される物質です。
三酸化二ヒ素と呼ばれることもあり、CAS登録番号は1327-53-3です。天然には方砒素華、クロード石などの鉱物としてわずかに存在しますが、非常に強い毒性があります。
具体例として、土呂久鉱山では過去に三酸化ヒ素の鉱石によって多数の死者が出たという事件が挙げられます。
三酸化ヒ素の使用用途
三酸化ヒ素は非常に強い毒性を持つため、殺鼠剤、殺虫剤や、農薬として使用されてきた歴史があります。虫歯や白血病治療薬にも用いられてきましたが、副作用として慢性ヒ素中毒やガンにかかることが多く、近年では使用が減少しつつあります。
工業的には金属ヒ素やヒ素化合物を製造する際の原料として用いられる物質です。その他には、触媒、ガラスの脱色、脱硫剤、顔料、染料製造、媒染剤、魚網・皮革の防腐剤、散弾用鉛の硬化剤、半導体製造におけるドーピングや、結晶育成原料などの用途を挙げることができます。
三酸化ヒ素の性質

図1. 三酸化ヒ素の基本情報
三酸化ヒ素は、分子量197.841、融点312.2℃、沸点465℃であり、常温常圧において無色無臭の固体です。昇華性があるため、強く加熱すると酸化ヒ素 (III) のガスを発生します。このガスは強い溶血作用を持つ性質があります。
密度は3.74g/mL、水への溶解度は20g/L (25°C)です。アルコール、クロロホルム、エーテルに溶けず、グリセリンに溶解します。水に溶かすと水和して亜ヒ酸 (As(OH)3) となり、弱酸性を示します。酸解離定数pKaは、9.2です。
三酸化ヒ素の種類
三酸化ヒ素は、主に研究開発用試薬製品として販売されています。容量の種類には、10g、25g、50g、100g、250g、1kgなどの種類があり、実験室で取り扱いやすい容量での提供です。室温で保管可能な試薬製品として扱われます。
毒物及び劇物取締法における毒物であるため、購入・保管には所定の手続きが必要です。
三酸化ヒ素のその他情報
1. 三酸化ヒ素の合成
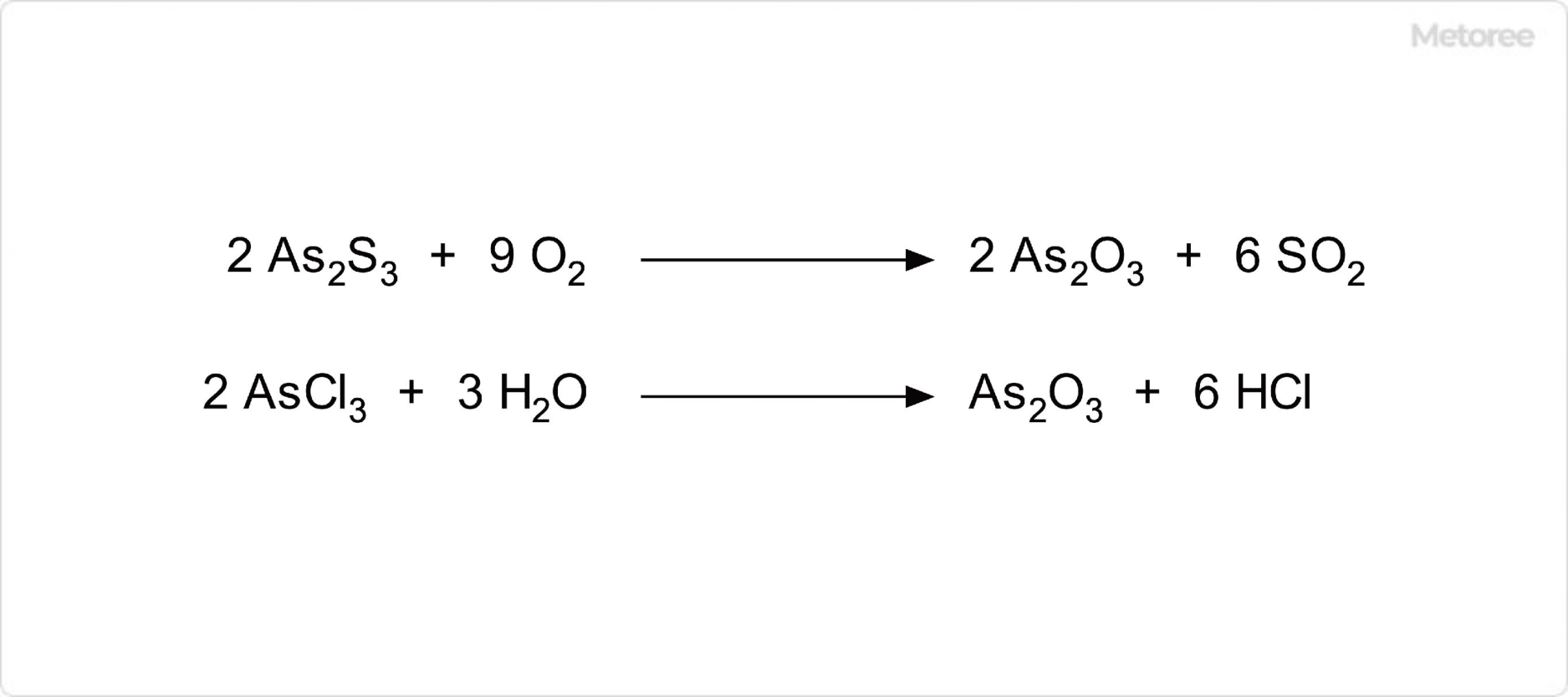
図2. 三酸化ヒ素の合成
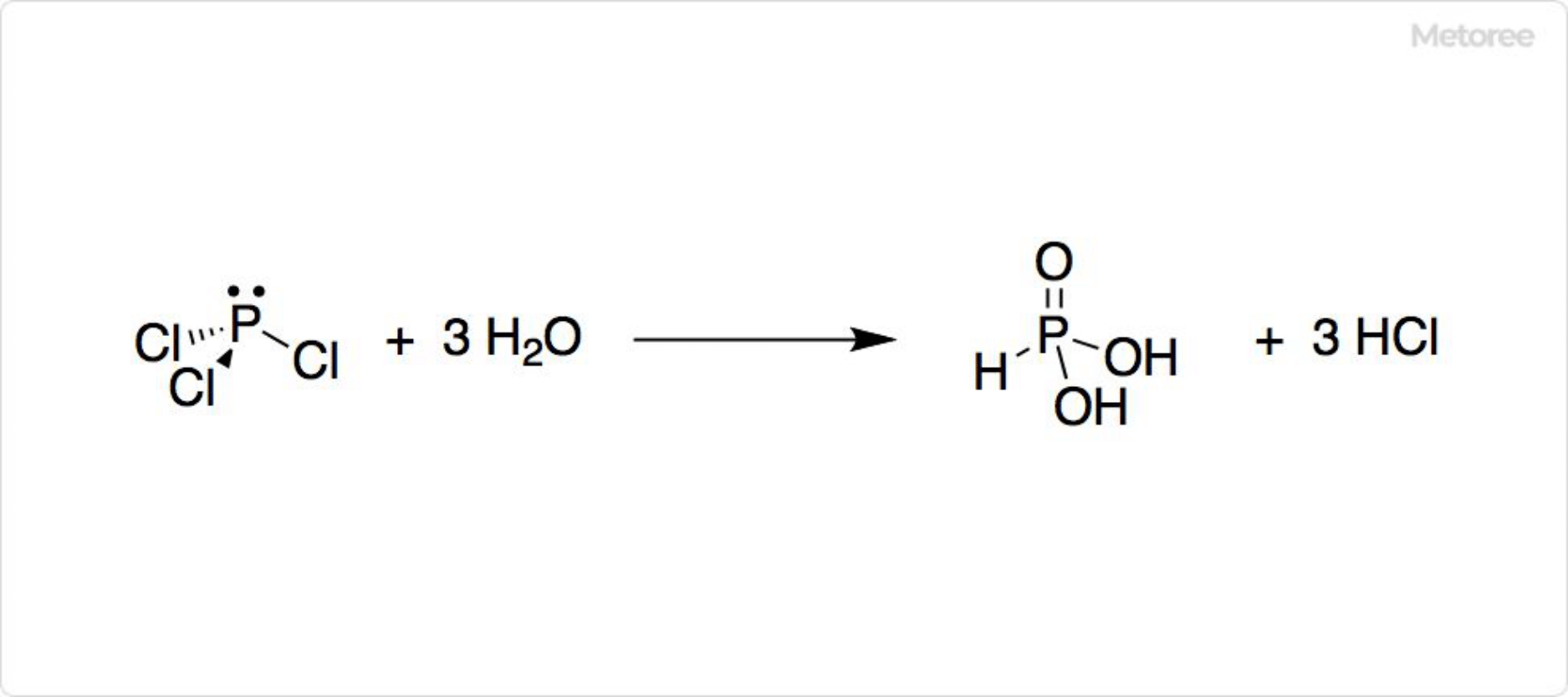
三酸化ヒ素は、硫化ヒ素を空気中で加熱する酸化反応によって得ることができます。実験室的製法では、三塩化ヒ素の加水分解によって得ることが可能です。
2. 三酸化ヒ素の化学反応
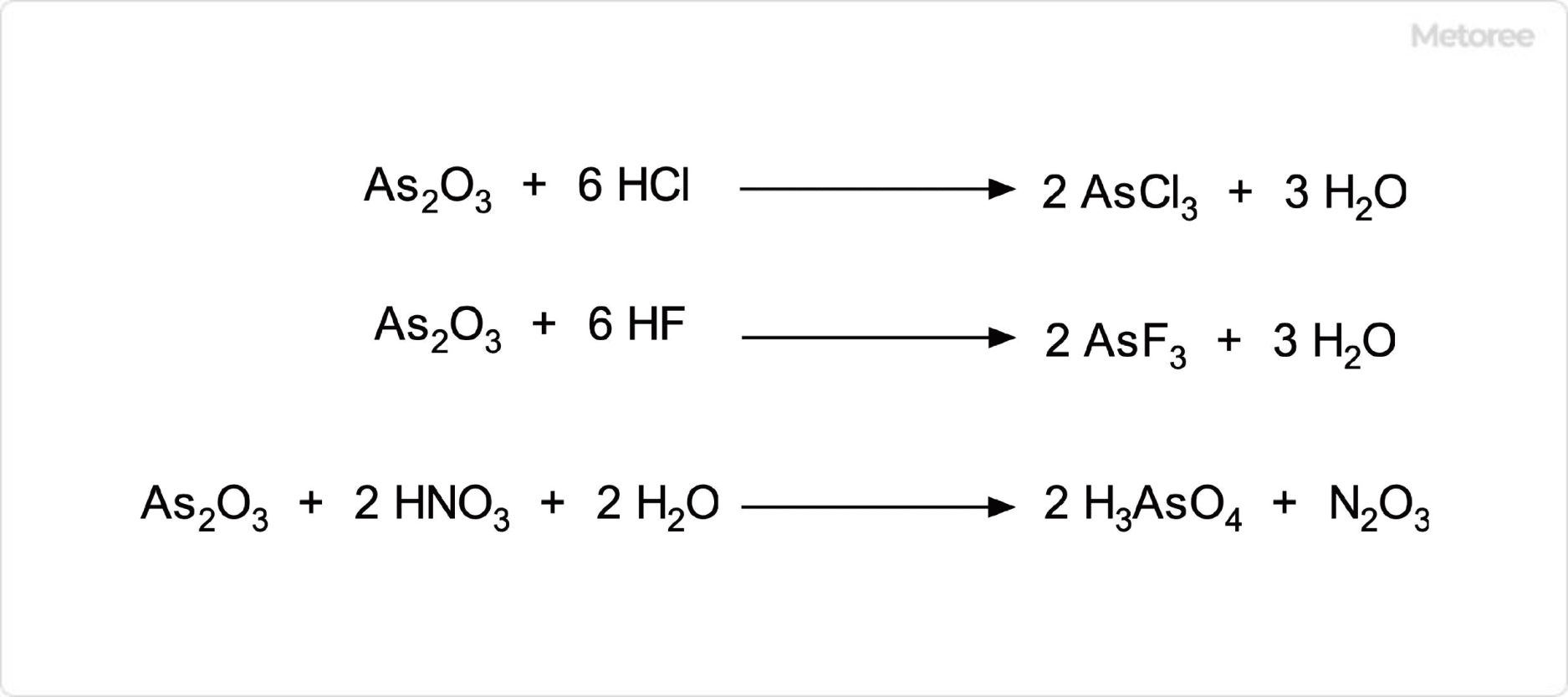
図3. 三酸化ヒ素の化学反応
三酸化ヒ素は、両性酸化物であり、酸とも塩基とも反応します。また、フッ化水素や塩化水素と反応して、それぞれフッ化ヒ素や塩化ヒ素を与えます。オゾン、過酸化水素、硝酸などの強い酸化剤によって酸化され、この反応の生成物はヒ酸もしくは五酸化二ヒ素です。
3. 三酸化ヒ素の有害性
三酸化ヒ素は、非常に毒性の強い化合物です。GHS 分類では、「急性毒性 (経口) : 区分2」「 眼に対する重篤な損傷・眼刺激性: 区分2A-2B」「生殖細胞変異原性: 区分2」「発がん性: 区分1A」「生殖毒性: 区分1A」などに分類されています。
具体的な危険としては、下記のものが挙げられます。
- 飲み込むと生命に危険
- 強い眼刺激
- 遺伝性疾患のおそれの疑い
- 発がんのおそれ
- 生殖能又は胎児への悪影響のおそれ
- 消化管、心臓、骨格筋、呼吸器の障害
- 長期又は反復ばく露による中枢神経系、末梢神経系、免疫系、呼吸器、肝臓、腎臓、皮膚、血管の障害
4. 三酸化ヒ素の法規制情報
三酸化ヒ素は前述の有害性により、毒物及び劇物取締法で毒物に指定されている物質です。それ以外にも、労働安全衛生法では、名称等を表示すべき危険有害物、及び、名称等を通知すべき有害物質、リスクアセスメントを実施すべき危険有害物、特定化学物質第2類物質、管理第2類物質、 特定化学物質特別管理物質に指定されています。
PRTR法では、第一種指定化学物質に指定されています。法令を遵守して正しく取り扱うことが厳しく求められる化合物です。