三塩化リンとは

三塩化リンとは、化学式がPCl3で表されるリンの塩化物です。
三塩化リンは600ppmでも数分で死に至るほど、毒性や危険性が高いです。GHS分類で、眼刺激性、皮膚刺激性、急性毒性 (経口) 、特定標的臓器毒性 (単回、反復ばく露) に分類されています。
三塩化リンの法規制は、労働安全衛生法で名称等を表示・通知すべき危険物および有害物に指定されています。リスクアセスメントを実施すべき危険有害物に該当しており、毒物・劇物取締法では毒物です。
三塩化リンの使用用途
三塩化リンの使用用途は幅広いです。例えば、難燃剤、酸化防止剤、可塑剤、殺虫剤、除草剤、水処理剤、界面活性剤などに用いられます。有機合成で有機ホスフィン配位子の導入剤や医薬中間体原料に使用可能です。
三塩化リンは、最も安価で多用途に用いられる3価のリン化合物です。そのため多くのリン化合物の出発原料に用いられています。難燃剤や可塑剤として広く利用される塩化ホスホリルのほか、医薬・有機合成の塩素化剤として広く用いられる五塩化リンなどの原料に利用されます。
三塩化リンの性質
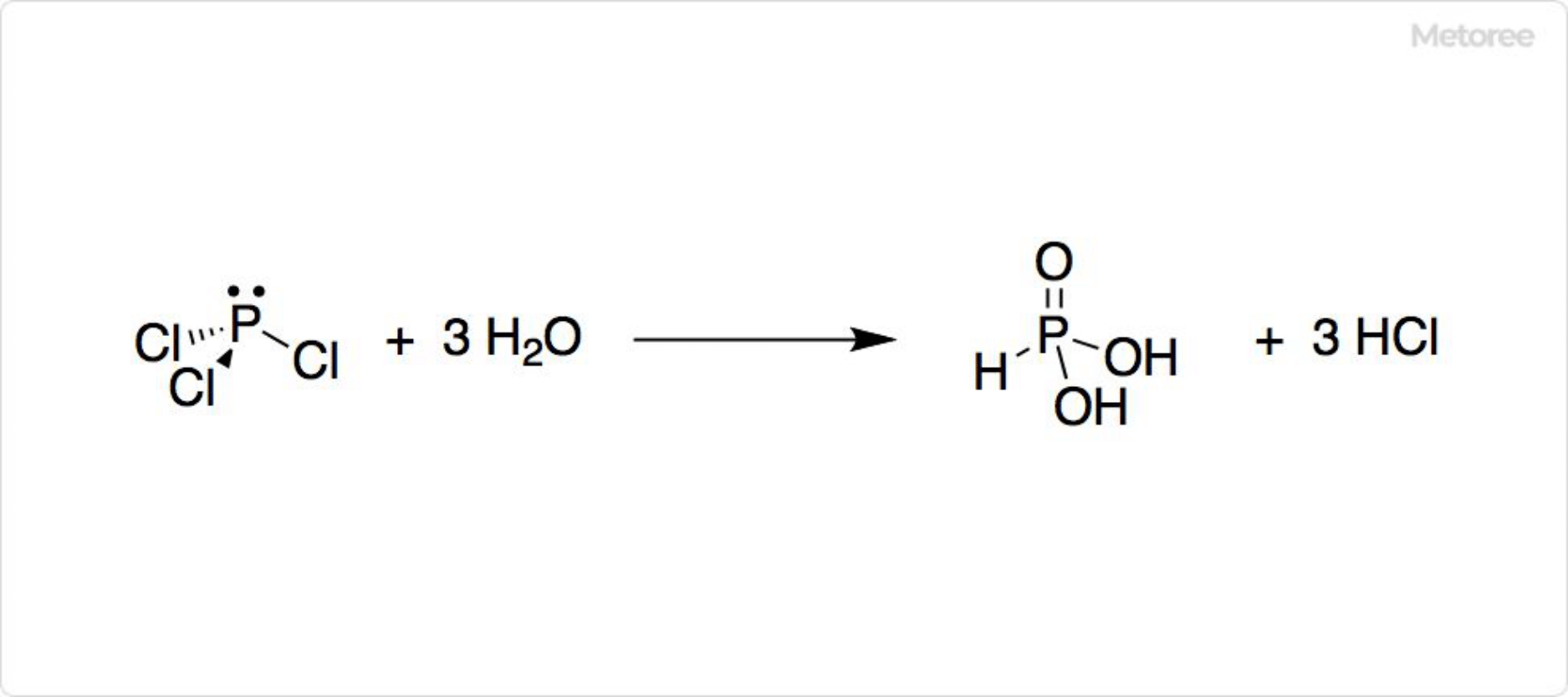
図2. 三塩化リンの加水分解
三塩化リンには刺激臭があり、さまざまな金属を腐食します。融点は−112°C、沸点は74〜78°Cで、無色または黄色の発煙性液体です。
エーテル、ベンゼン、四塩化炭素などに可溶です。水と激しく反応し、塩化水素が発生して、ホスホン酸になります。三塩化リンはNH3でP(NH2)3に、ROHでP(OH)3に、O2で塩化ホスホリル (POCl3) に、Sで塩化チオホスホリル (PSCl3) になります。
三塩化リンの構造
三塩化リンの分子量は137.33g/molで、密度は1.574g/cm3です。塩素原子の酸化数は−1価、リン原子の酸化数は+3価を取っています。
四塩化炭素中では0.8Dの双極子モーメントを有し、液体の標準生成エンタルピーは−319.7kJ/molです。三塩化リンの分子は、リン原子を頂点とした三方錐型構造を取っています。P-Clは2.039Åで、∠Cl-P-Clは100.27°です。
三塩化リンのその他情報
1. 三塩化リンの合成法
工業的には、黄リンや白リンに塩素を吹き込んで得られる三塩化リン溶液を加熱還流して、三塩化リンを合成する方法が知られています。実験室では、毒性が低い赤リンを用います。
2. 三塩化リンを用いたホスフィンの合成
有機リチウム試薬やグリニャール試薬を用いた置換反応によって、三塩化リンから多種多様な有機ホスフィン化合物を合成可能です。例えば、グリニャール試薬 (RMgX) との反応によって、トリアルキルホスフィン (PR3) が生じます。
3. 三塩化リンとアルコールの反応
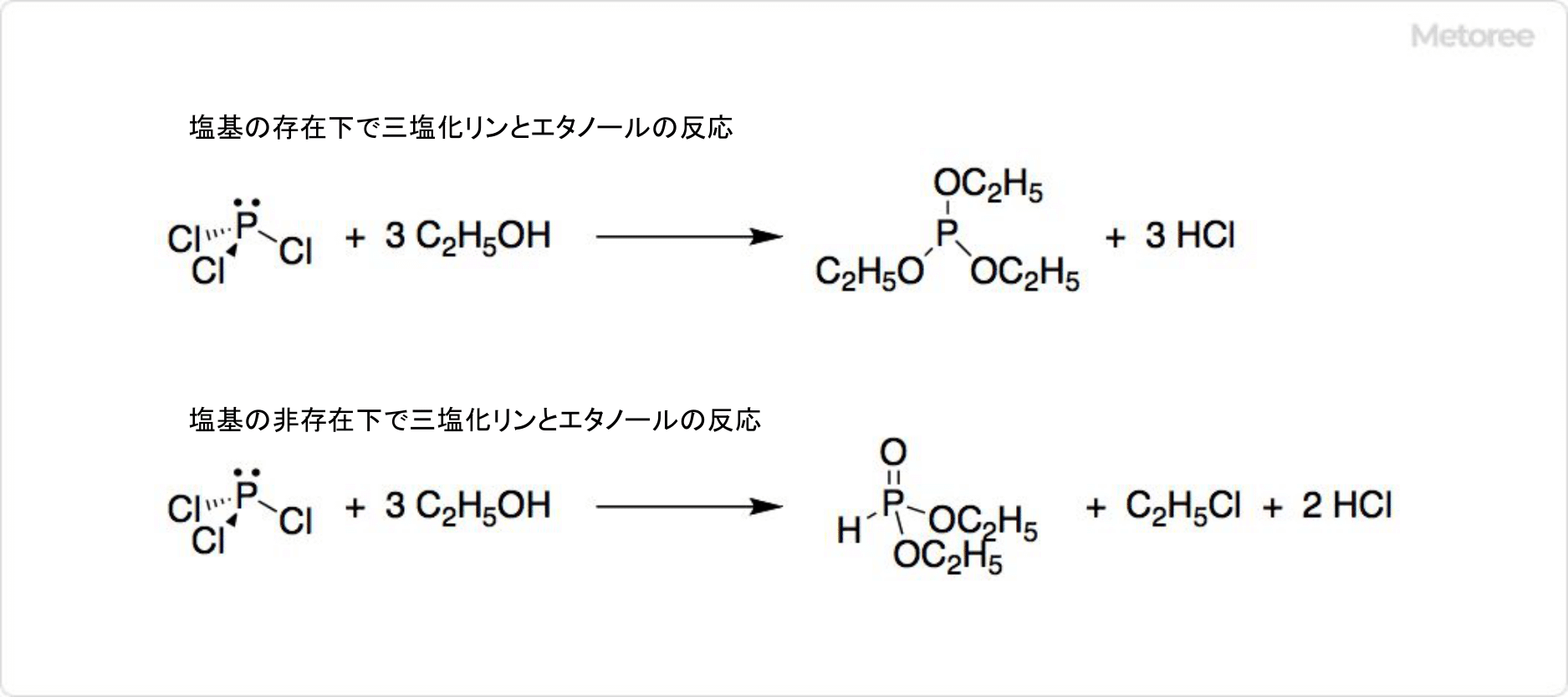
図3. 三塩化リンの反応
トリエチルアミンなどの塩基の存在下で、エタノールと反応して亜リン酸トリエチルが得られます。塩基が存在しないときには、クロロエタンとホスホン酸ジエチルが生じ、反応条件次第で塩化アルキルと亜リン酸を与えます。フェノールと反応すると、亜リン酸トリフェニルを生成可能です。
4. 三塩化リンとアミンの反応
2級アミンとの反応によって亜リン酸トリアミドが生成し、チオールが反応するとトリチオ亜リン酸トリアルキルを合成可能です。ホルムアルデヒドまたはパラホルムアルデヒドを使用して、2級アミンとの反応によりアミノホスホン酸が合成できます。アミノホスホン酸は、水質改善のために、水垢防止剤や金属封鎖剤として利用可能です。
5. 三塩化リンのその他反応
三塩化リンは芳香環と置換反応が起こります。具体的には、ベンゼンと反応すると、PhPCl2を合成可能です。非共有電子対を持っている三塩化リンは、ルイス塩基としても働きます。ルイス酸であるBBr3と1:1付加物のBr3B–-PCl3+を生成可能です。Ni(PCl3)4などの金属錯体も知られています。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7719-12-2.html