全てのカテゴリ
閲覧履歴


亜硝酸についての概要、用途、原理などをご説明します。また、亜硝酸のメーカー2社一覧や企業ランキングも掲載しておりますので是非ご覧ください。
目次
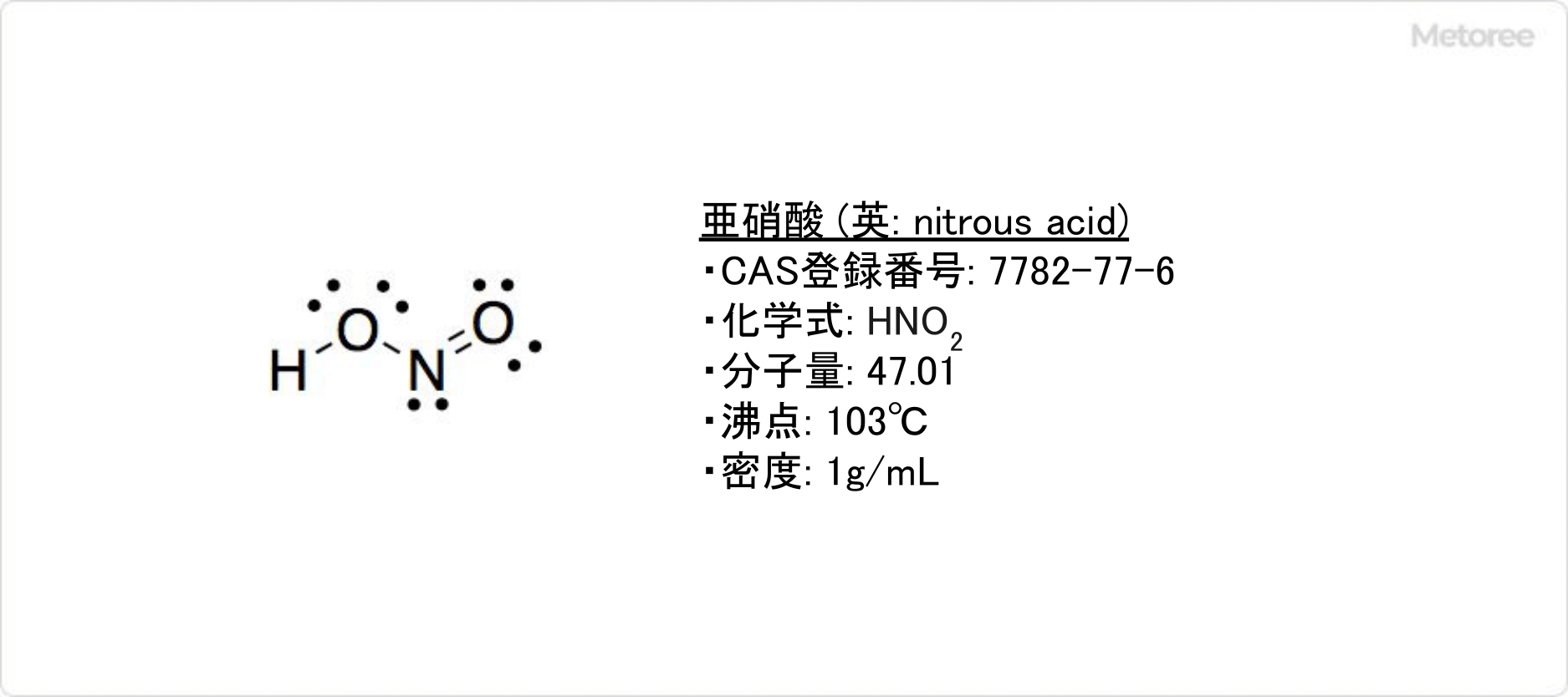
図1. 亜硝酸の基本情報
亜硝酸とは、温めると一酸化窒素と硝酸が生成される淡青色の弱酸です。
水溶液および蒸気の状態でのみ存在します。密度は1g/cm3、沸点は103℃です。亜硝酸は亜硝酸バリウムと希硫酸、もしくは亜硝酸銀と塩酸などの組み合わせで、低温の水溶液中で反応させ沈殿を濾別することによって、水溶液として得られます。
また、一酸化窒素と二酸化窒素の混合物を、氷水に溶かすことによっても亜硝酸が生成します。
亜硝酸は有機アミンと反応させることで、ジアゾニウム塩 (英: diazonium salt) の合成に用いられます。このジアゾニウム塩は、種々の芳香族化合物の合成のための中間体として利用されています。
また、アルコールと安定なエステルを作ることが可能です。生成された特定のアルキルエステルは、血管拡張剤として医薬品に用いられています。例えば、亜硝酸アミルは、血管拡張剤やシアン化合物解毒剤等として使用されています。
亜硝酸ナトリウムなどの亜硝酸塩は、加工肉の発色剤に用いられ、強い食中毒菌であるボツリヌス菌を抑制する物質として使用可能です。亜硝酸がヘム鉄に配位して鮮赤色を呈するため、ソーセージのような食品添加物として使われています。
亜硝酸は弱酸であり、希薄水溶液中での酸解離定数はpKa = 3.3で、硝酸と比べて105程度も小さいです。遊離酸の状態では不安定で分解しやすく、水中では直ちに酸化窒素と硝酸に分解します。
そのため、亜硝酸塩や亜硝酸エステルといった形で保存されています。酸化と還元の両方の作用を有しており、反応性が高いです。強い酸化剤によって、硝酸に酸化されます。
さらに、ヨウ化物によって一酸化窒素に、二酸化硫黄によってヒドロキシルアミンに、亜鉛によってアンモニアに還元されます。酸化剤としての標準酸化還元電位はE° = 0.996V、還元剤としての標準酸化還元電位はE° = 1.093Vです。
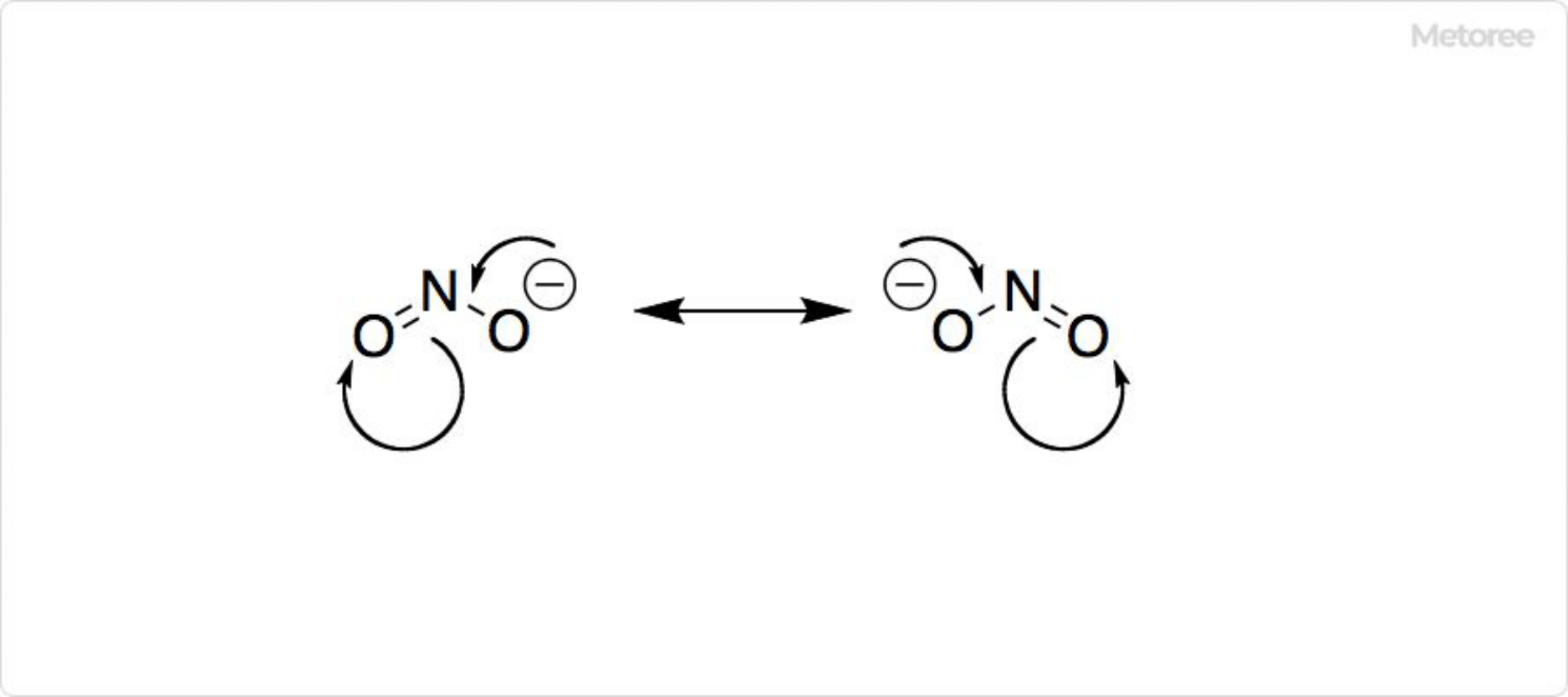
図2. 亜硝酸イオンの共鳴構造
亜硝酸はIUPAC命名法系統名では、ジオキソ硝酸 (英: dioxonitric(III) acid) です。窒素のオキソ酸の1つで、化学式はHNO2、モル質量は47.01です。
亜硝酸の気体分子は、H-O-N-O型構造を取っています。∠H-O-Nと∠O-N-Oは、それぞれ102°と111°です。シス形とトランス形の両形がありますが、トランス形の方が安定です。

図3. 亜硝酸によるジアゾニウム塩の生成と分解
亜硝酸が二級アミン類と反応した場合にはニトロソアミン体になり、芳香族一級アミンと反応した場合には脱水によって芳香族ジアゾニウムイオンが生じます。ジアゾニウム化合物 (英: diazonium compound) とは、分子内に−N+≡Nを含んだ有機窒素化合物のことです。
一価のモノカチオン性置換基をジアゾニオ基 (英: diazonio) 、R−N+≡Nと表されるカチオンのことをジアゾニウムイオン (英: diazonium ion) 、ジアゾニウムイオンを含む塩をジアゾニウム塩と呼びます。ジアゾニウムイオンは反応性が高いです。
ジアゾニウムイオンはザンドマイヤー反応 (英: Sandmeyer reaction) による置換反応やジアゾカップリング (英: azo coupling) によるアゾ化合物合成といった用途があります。多くのアゾ化合物は呈色するため、色素の合成の際に有用です。
亜硝酸イオンはさまざまな金属に配位することが可能です。窒素で配位した錯体のことをニトロ錯体、酸素で配位した錯体のことをニトリト錯体と呼びます。
代表的な亜硝酸塩には、亜硝酸カリウム (KNO2) 、亜硝酸カルシウム (Ca(NO2)2) 、亜硝酸銀 (AgNO2) 、亜硝酸ナトリウム (NaNO2) 、亜硝酸バリウム (Ba(NO2)2) などが挙げられます。
*一部商社などの取扱い企業なども含みます。




社員数の規模
設立年の新しい会社
歴史のある会社