亜リン酸とは
亜リン酸 (英: Phosphorous acid) とは、H3PO3の化学式を有するリンのオキソ酸の無機化合物です。
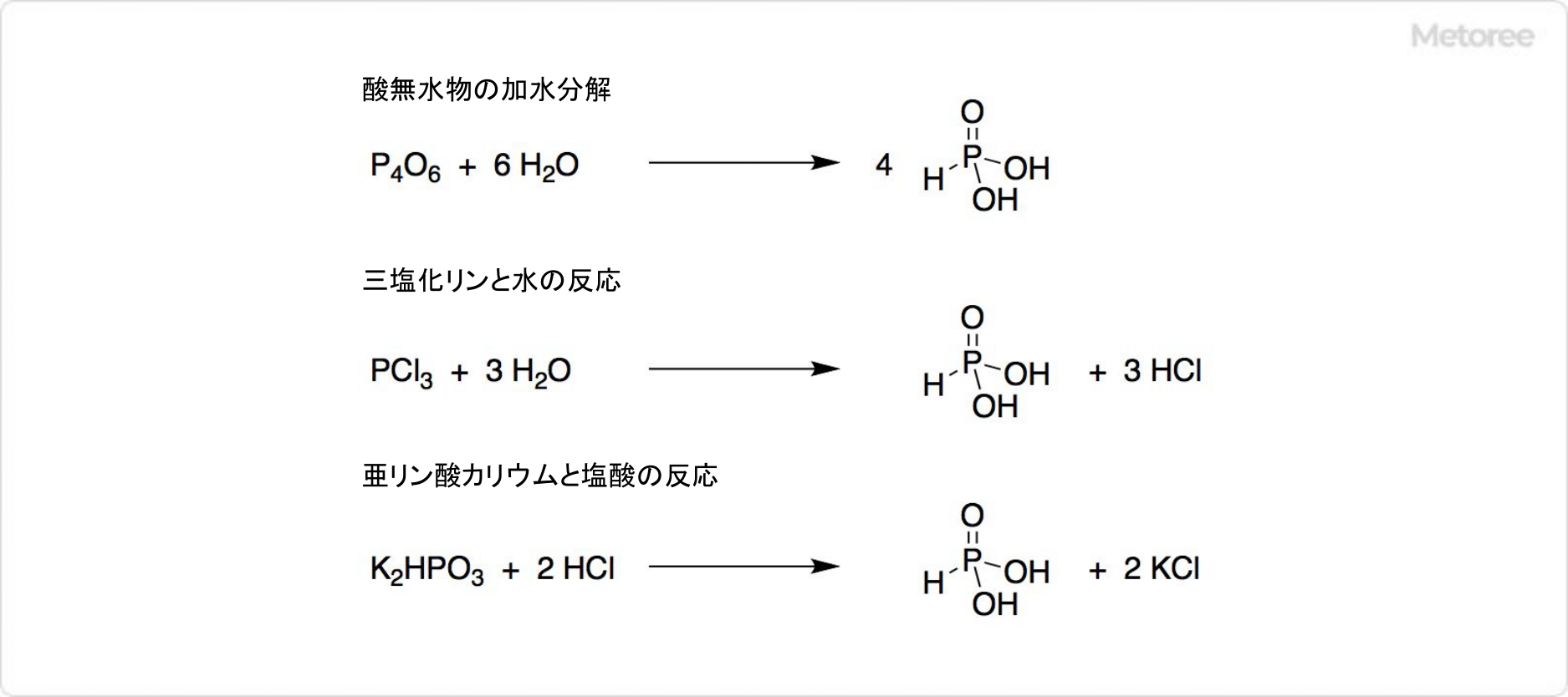
リン酸や次亜リン酸と同じく、リンのオキソ酸の一つです。酸無水物の加水分解で合成できます。
亜リン酸は、三塩化リンを水や水蒸気により加水分解する製造法が良く使われ、最近では肥料への用途が注目を浴びています。亜リン酸の前駆体である亜リン酸カリウムは、過剰な塩酸で処理されて、アルコールによる濃縮や沈殿により、純粋な亜リン酸を分離可能です。
亜リン酸の使用用途
亜リン酸は塩化ビニールの製造に使用する安定剤だけでなく、有機化合物を合成するための触媒や還元剤に使用されています。
作物の肥料に使う亜リン酸塩の原料などにも、亜リン酸を利用可能です。作物の肥料の三大要素である窒素・リン酸・カリウムの中で、リン酸は通常のリン酸肥料が使われています。しかし近年、さまざまな亜リン酸肥料が、肥料メーカーから発売されています。亜リン酸はリン酸より分子量が小さく、溶解性が良く、作物内での移行性も良いため、吸収されやすく、土壌への吸着性が小さいです。
亜リン酸とカリウムを主成分とした粒状や液体の亜リン酸肥料もあります。適切に使用すれば、収量が増え、品質も向上できます。
亜リン酸の性質
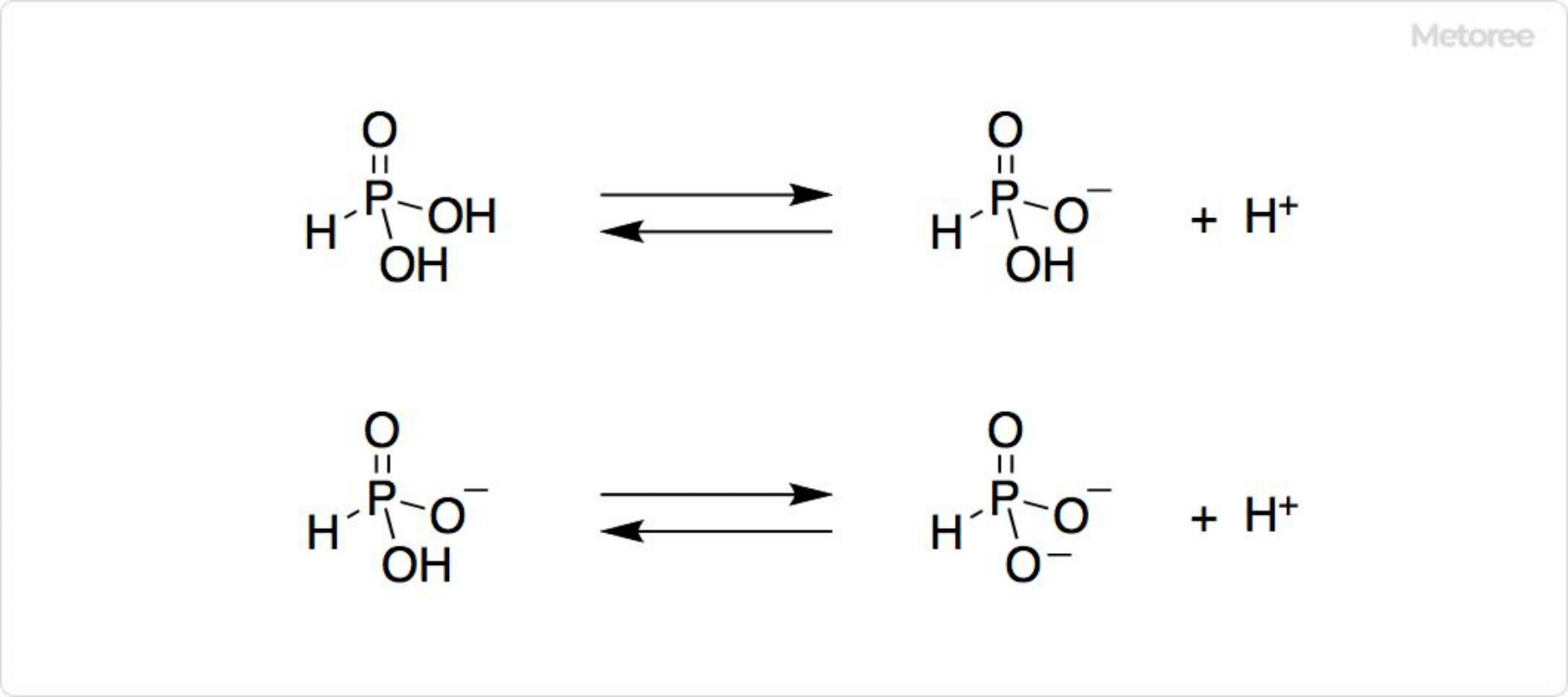
図2. 水溶液中の亜リン酸
亜リン酸は白色の結晶です。常温常圧では安定ですが、潮解性があります。水溶液中では圧倒的にHP(O)(OH)2の化学種が優勢で、2価の酸として作用し、pHが約1の酸性を示します。pKa1=1.5、pKa2=6.79です。
亜リン酸の還元性は比較的強いです。硝酸銀、塩化金(III)、硫酸銅水溶液から、それぞれの金属が遊離します。酸性水溶液中での標準酸化還元電位はE°=-0.276Vです。
亜リン酸塩の還元作用は強いです。アルカリ金属やアンモニウムの亜リン酸塩は、水に溶けます。その一方で、アルカリ土類金属やその他の亜リン酸塩の多くは、水に溶けにくいです。
亜リン酸の構造
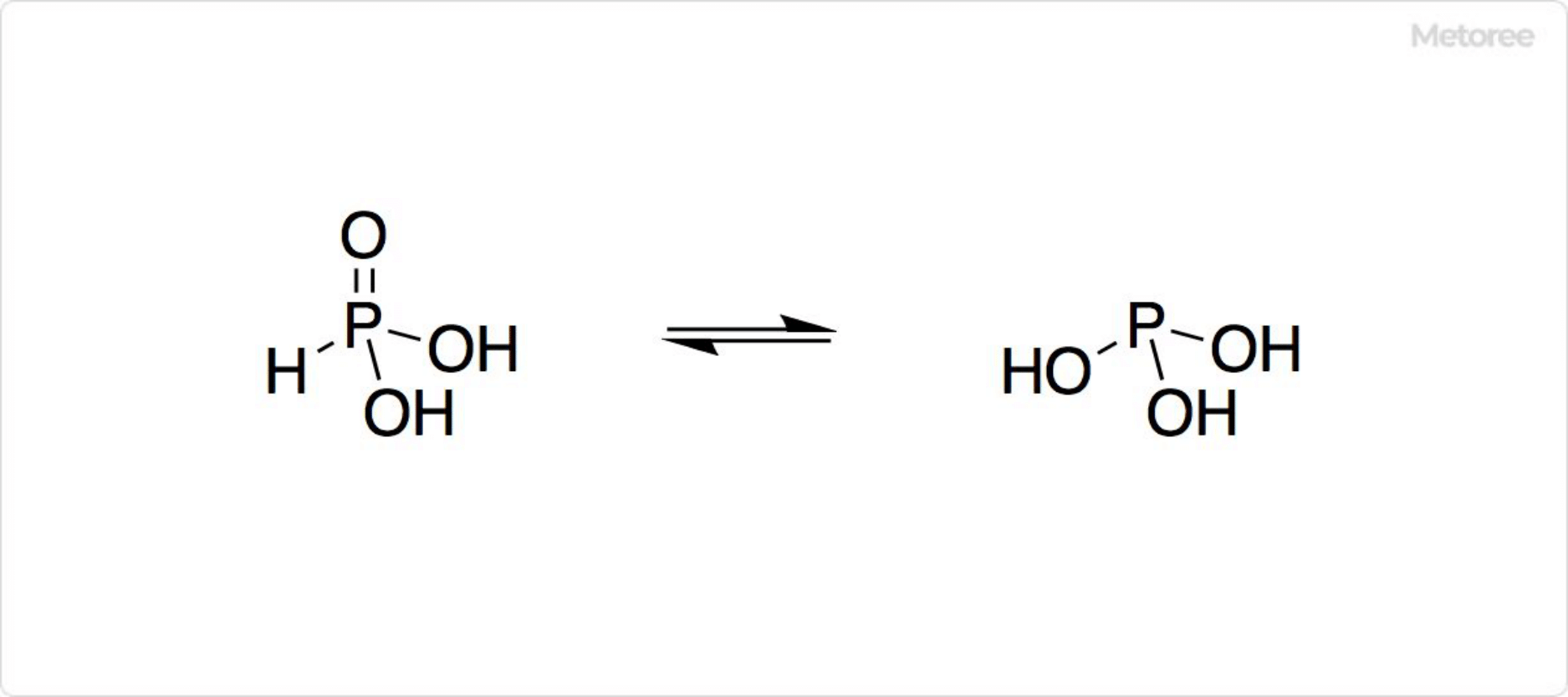
図3. 亜リン酸の構造
いくつかのリン酸類はPとOとの間でHが移動し、複雑に互変異性化します。亜リン酸はHP(O)(OH)2に互変異性化し、P(OH)3よりHP(O)(OH)2の方が優位です。トリヒドロキシ型が亜リン酸で、ジヒドロキシ型はホスホン酸 (英: phosphonic acid) と呼ばれます。
ホスホン酸を含有する製剤は、毒劇法で劇物に指定されています。固体状態で亜リン酸は四面体構造を取っており、P-H間が132pmで、P=O間が148pmで、P-O(H)間が154pmです。
亜リン酸のその他情報
1. 亜リン酸の異性体
亜リン酸は、溶液中では互変異性体のホスホン酸との平衡混合物になっています。化学種の平衡は亜リン酸が劣勢です。
有機化学では、一般式がR-P(=O)(OH)2と表される化合物もホスホン酸と呼んでいます。有機ホスホン酸の具体例としてホスカルネット (英: foscarnet) があり、抗ウイルス薬の一つです。P-アルキルホスホン酸のジエステルであるR-P(=O)(OR’)2は、ホーナー・ワズワース・エモンズ反応 (英: Horner-Wadsworth-Emmons reaction) の基質です。ホーナー・エモンズ試薬とも呼ばれ、アルケンの原料になります。
2. 亜リン酸の関連化合物
亜リン酸はリンのオキソ酸です。リンの酸化数が5のオキソ酸には、リン酸 (H3PO4) 、二リン酸 (H4P2O7) 、三リン酸 (H5P3O10) 、メタ三リン酸 (H3P3O9) などがあります。リン酸はオルトリン酸とも呼ばれ、ピロリン酸などのリン酸骨格を有する類似化合物群をリン酸類と呼びます。ホスフィン酸はリンの酸化数が1のオキソ酸です。ホスフィン酸の分子式はH3PO2と表されます。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/13598-36-2.html
https://elaws.e-gov.go.jp/document?lawid=340CO0000000002