塩素酸カリウムとは
塩素酸カリウム (英: Potassium chlorate) とは、カリウムの塩素酸塩であり、組成式KClO3で表される物質です。
別名には、塩剥、塩素酸カリなどの名称があります。また、価数を明示して塩素(V)酸カリウムと表記される場合もあります。CAS登録番号は、3811-04-9です。
塩素酸カリウムの使用用途
塩素酸カリウムの主な使用用途は、 爆薬、マッチ (頭薬部分) 、分析用試薬、印刷インキ、漂白剤、染料、防腐剤、除草剤、医薬品、花火です。塩素酸カリウムと硫黄との混合物は、摩擦によって発火する性質を持ちます。
また、塩素酸カリウムは強力な酸化剤としての性質がある物質です。これらの性質故に、塩素酸カリウムは、花火や爆薬といった主に発火や燃焼に関連する製品の原料に使われています。
医療・医薬分野では、塩素酸カリウム水溶液をうがい薬として使用する場合もあります。
塩素酸カリウムの性質
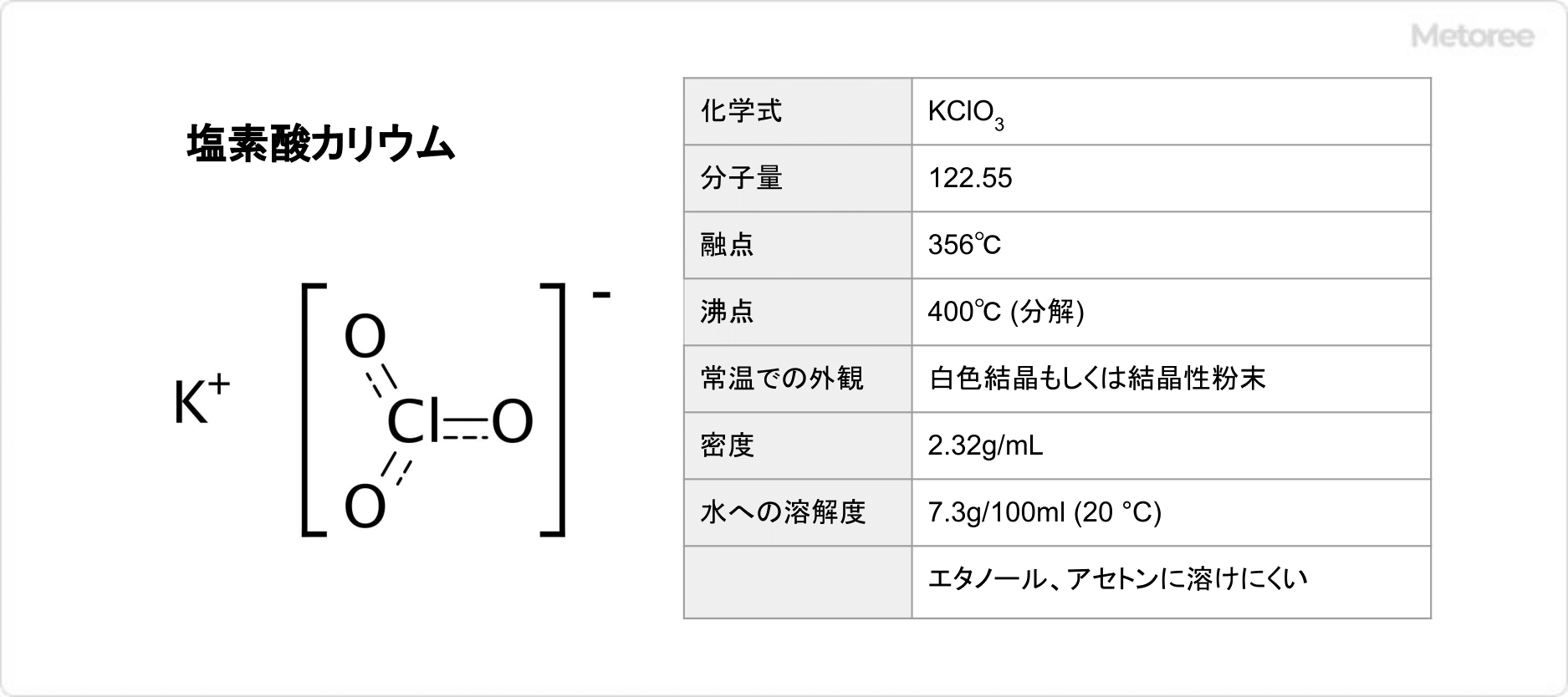
図1. 塩素酸カリウムの基本情報
塩素酸カリウムは、分子量122.55、融点356℃であり、常温での外観は白色結晶もしくは結晶性粉末です。
臭いはありません。水にやや溶けます (溶解度: 7.3g/100ml (20 °C)) が、エタノールに極めて溶けにくく、アセトンに溶けません。密度は2.32g/mLです。
塩素酸カリウムの種類
塩素酸カリウムは、主に研究開発用試薬製品や産業用無機薬品として販売されています。研究開発用試薬製品としては、25g、500gなどの容量の種類があり、実験室で取り扱いやすい容量で提供されている物質です。
通常、室温で保管可能な試薬製品として取り扱われています。産業用無機薬品としては、使用用途の多さから複数のメーカーで提供があります。こちらの場合は、メーカーへの個別の問い合わせが必要です。
塩素酸カリウムのその他情報
1. 塩素酸カリウムの合成
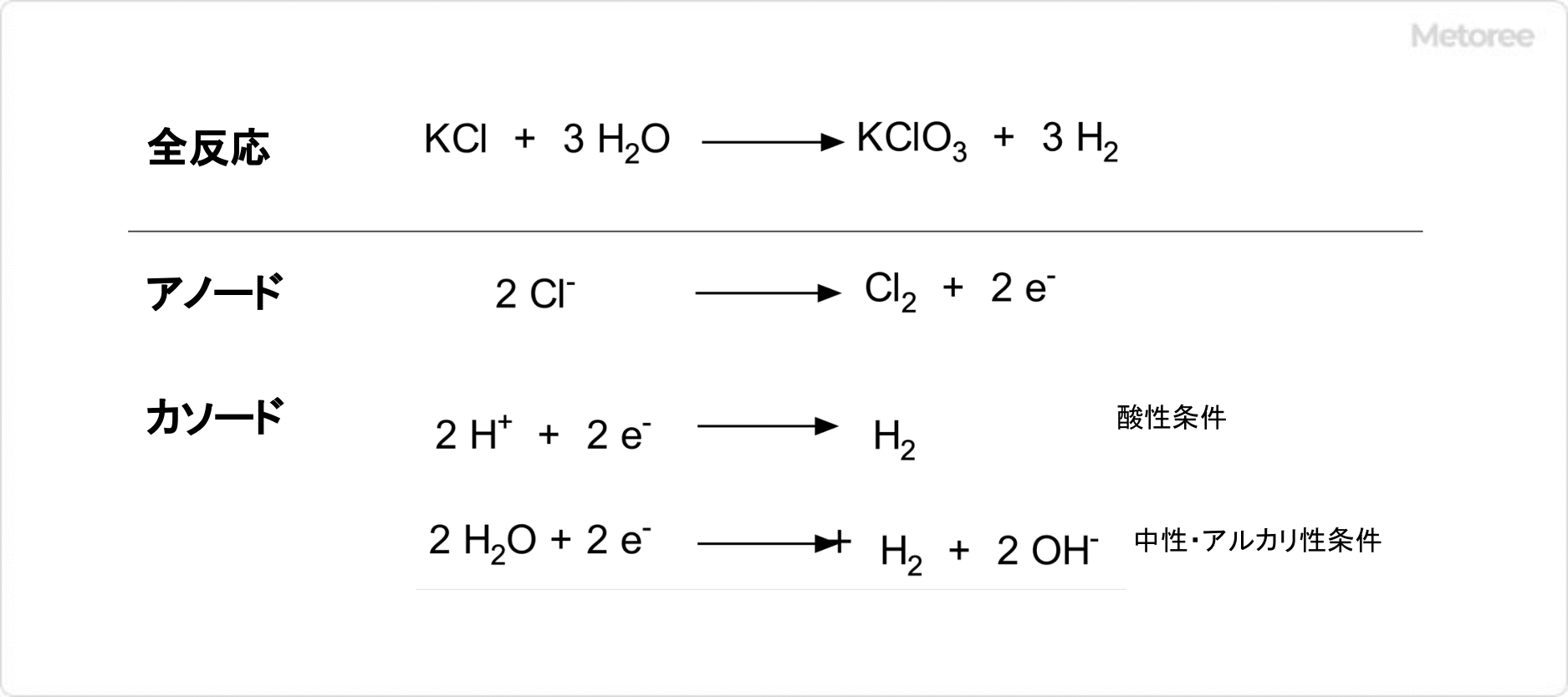
図2. 電気分解による塩素酸カリウムの合成
塩素酸カリウムは、塩化カリウムの飽和水溶液の電気分解により合成が可能です。アノード (陽極) として、MMO電極 (混合金属酸化物電極) 、白金、黒鉛、二酸化鉛などの不溶性電極が使用され 、カソード (陰極) として、チタン、ステンレス鋼、軟鋼などが用いられます。
この際、アノードの侵食を抑制するために次の3つの条件を満たすことが必要です。
- アノード上での電流密度の上限はMMO電極や白金では200~300mA/cm2、黒鉛では30mA/cm2程度とし、アノードを囲むようにカソードを配置する (アノード表面での電流密度の偏りを防ぐため)
- 溶液中の塩化カリウム濃度を飽和状態に保つため、減少した分の塩化カリウムを定期的に補給する
- アノード周辺の溶液の温度を40℃以下に維持する
2. 塩素酸カリウムの反応性
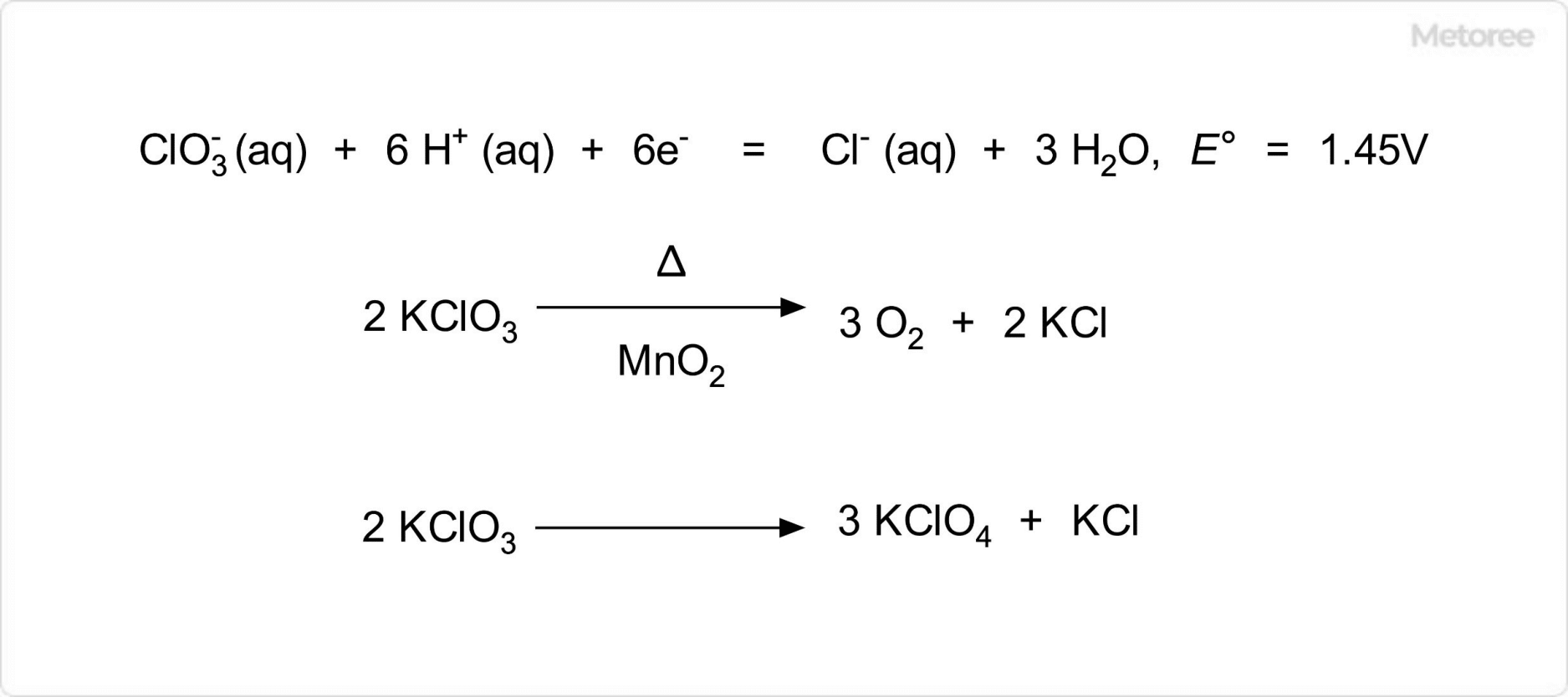
図3. 塩素酸カリウムの酸化還元電位と分解反応
塩素酸カリウムは、酸性条件において強い酸化力を示します。中性およびアルカリ性溶液では酸化作用を示すことは少なく、水溶液は基本的に中性です。
二酸化マンガンなどの金属酸化物を触媒として加熱すると、酸素を放出して、塩化カリウムになります。また、触媒非存在下で加熱すると、過塩素酸カリウムと塩化カリウムに分解します。
3. 塩素酸カリウムの危険性と法規制情報
塩素酸カリウムは、反応性が高い物質です。多くの可燃性物質 (有機物や硫黄、リン、炭素など) と混合し点火すると激しく燃焼し、自発的・偶発的に発火や爆発することもあります。また、濃塩酸や濃硫酸、濃硝酸に接触するだけで爆発する可能性があるため、必ず強酸類と離して保管しなければなりません。
これらの危険性により、塩素酸カリウムは法令によって規制を受ける化合物です。毒物及び劇物取締法において劇物、及び、 発火性又は爆発性のある劇物に指定されており、労働安全衛生法では危険物・酸化性の物に指定されています。消防法では、 第1類酸化性固体、塩素酸塩類に指定されています。法令を遵守して正しく取り扱うことが必要です。