テトラリンとは
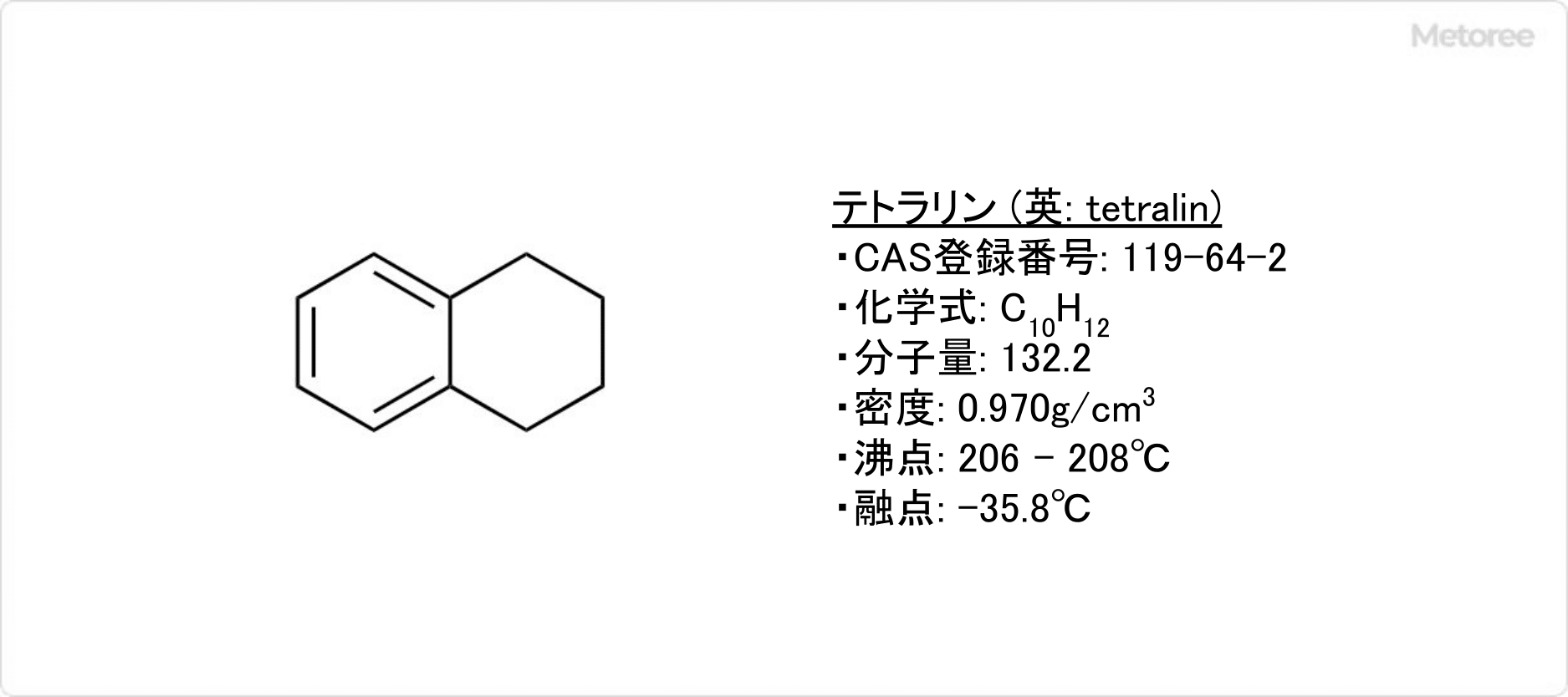
テトラリンとは、脂環式化合物の1つで、無色の液体です。
別名、1,2,3,4-テトラヒドロナフタレン (英: 1,2,3,4-tetrahydronaphthalene) とも呼ばれます。ナフタレンの一方のベンゼン環が水素化されて飽和していますが、他方はベンゼン環のまま残っています。
そのため、脂肪族と芳香族の両方の性質を持つことが特徴です。天然では石炭タール油に含まれており、消防法にて「第4類引火性液体」に指定されています。
テトラリンの使用用途
テトラリンは、主に、塗料用の溶剤として利用される他、油脂・脂肪・樹脂・ゴム・ロウ・接着剤等の溶剤としても用いられています。また、機械部品等の油脂の洗浄剤としても使用可能です。特に、浸透力が大きいため、通常の溶剤では洗浄しにくい細かい部分の洗浄を得意としています。
他にも医薬中間体を作る際の反応溶媒としても用いられています。さらに、水素化することによって、デカリンが生成されるため、その合成原料として利用可能です。その他、臭素と反応することによって、臭化水素を発生するため、臭化水素の実験室的製造に使用されることもあります。
テトラリンの性質
テトラリンは、水には溶けず、エタノール・エーテル・ベンゼン等の有機溶媒に溶けます。融点は-35.8°C、沸点は206-208°C、引火点は77°C、発火点は385°Cです。
酸化されると無水フタル酸となり、脱水素されるとナフタレンを生成します。空気によって酸化されやすいです。酸化によって爆発性のテトラリンヒドロペルオキシド (英: tetralin hydroperoxide) が生じます。
テトラリンヒドロペルオキシドは、1-ヒドロペルオキシ-1,2,3,4-テトラヒドロナフタレン (英: 1-hydroperoxy-1,2,3,4-tetrahydronaphthalene) とも呼ばれます。したがって、古いテトラリンを蒸留する際には注意が必要です。
テトラリンの構造
テトラリンの化学式はC10H12です。モル質量は132.2g/molで、密度は0.970g/cm3です。
芳香族炭化水素の1種であり、炭素の骨格がナフタレンと似ていますが、片方の環は水素化され飽和した構造となっています。
テトラリンのその他情報
1. テトラリンの合成法
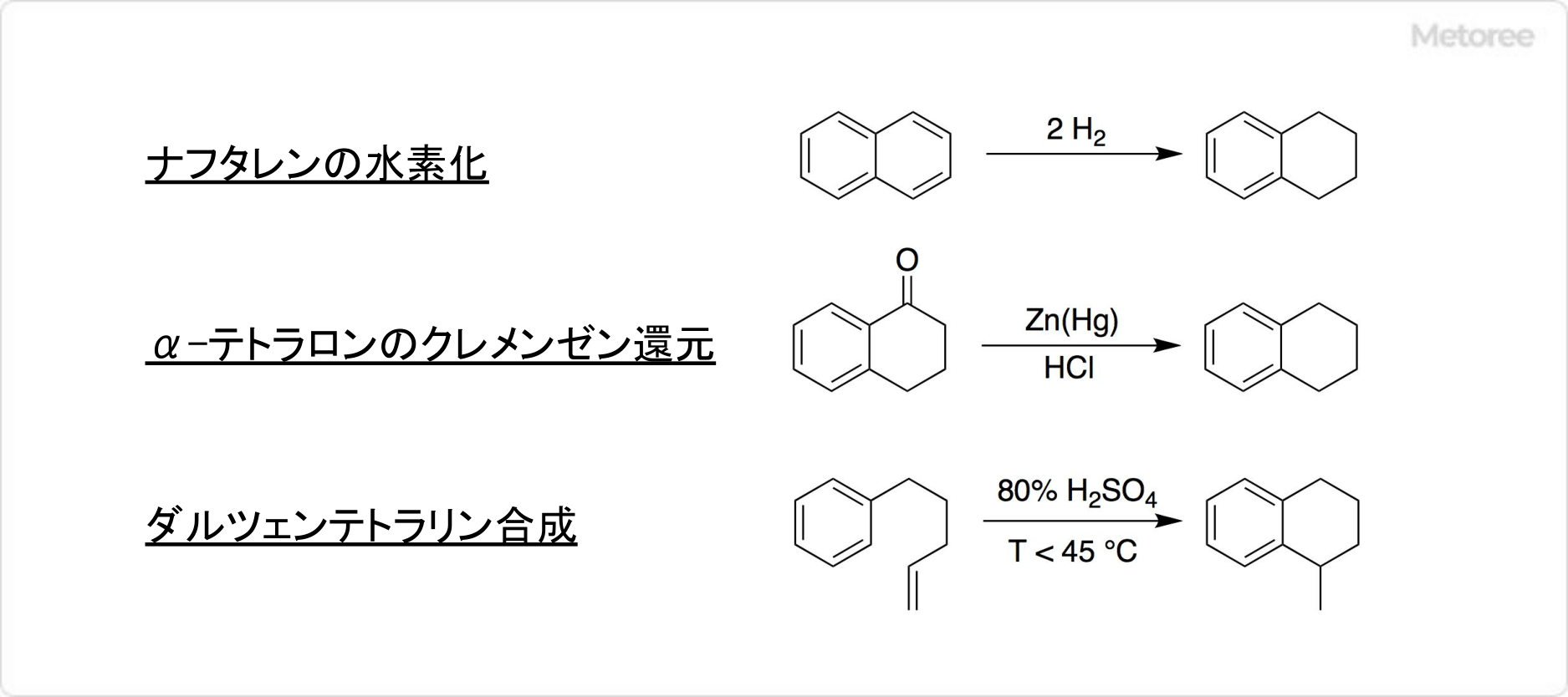
図2. テトラリンの合成法
ニッケル触媒を用いて、ナフタレンを水素化することによってテトラリンは得られます。α-テトラロンの亜鉛アマルガムと塩酸による、クレメンゼン還元という方法でも生成可能です。
古典的には、ダルツェンテトラリン合成 (英: Darzens tetralin synthesis) により生成できます。つまり4-アリール-1-ペンテンに硫酸を反応させることで、メチルテトラリン誘導体へと環化させる合成法です。
2. テトラリンのバーグマン環化による合成

図3. テトラリンのバーグマン環化による合成
テトラリン骨格は、正宗・バーグマン環化 (英: Masamune–Bergman cyclization) を用いても合成可能です。水素供与体存在下でエンジイン (英: enediyne) を加熱すると転位反応が起き、正宗・バーグマン環化芳香族化や正宗・バーグマン反応とも呼ばれています。
3. テトラリンのバーグマン環化の反応機構
正宗・バーグマン環化は、熱反応や200°C以上の熱分解によって起こります。まず反応性の高い短寿命のp-ベンザインビラジカル種が生じ、1,4-シクロヘキサジエンなどのあらゆる水素供与体と反応することが可能です。
例えば反応生成物は、四塩化炭素の場合には1,4-ジクロロベンゼンで、メタノールではベンジルアルコールになります。シクロデカ-3-エン-1,5-ジイン (英: cyclodec-3-en-1,5-diyne) のように、エンイン部分を有する10員環炭化水素環を用いると、反応物の環歪みが大きくなるため、37°C以下でも反応が起きます。