塩素酸とは
塩素酸 (英: Chloric acid) とは、化学式HClO3で表される塩素のオキソ酸の1種です。
酸化数+5価の塩素原子を中心として、1つのヒドロキシ基と2つの酸素原子で構成されます。CAS登録番号は7790-93-4です。塩素酸の遊離酸は単離することができず、水溶液としてのみ得られます。
塩素酸の使用用途
塩素酸の関連物質である塩素酸ナトリウムは、EUにおいて環境への影響のため除草剤としての使用が2009年に禁止されています。
1. 酸化剤・漂白剤
塩素酸の水溶液は強酸であり、強い酸化力を持つ物質です。強力な漂白効果を有しており、パルプを始め様々な物質の漂白剤として工業的に利用されています。
また、多くの金属とその酸化物、水酸化物、炭酸塩を溶解させることで、塩素酸塩 (塩素酸ナトリウム、塩素酸カリウム、塩素酸アンモニウム、塩素酸亜鉛など) の原材料としても利用されています。
2. 火薬・爆薬
塩素酸の塩は、火薬や爆薬の原料としても使用されてきた歴史があります。純度98%の塩素酸ナトリウムが農薬として使用されていたこともありましたが、爆発の危険性が高く、また非合法の爆発物として利用される例が頻発して社会問題となりました。
これにより、1970年代以降は炭酸ナトリウムなどが配合された薬剤が主流となっています。
塩素酸の性質

図1. 塩素酸の基本情報
塩素酸の分子量は84.46であり、10%以下の濃度の水溶液の融点は-20℃、沸点は40℃です。水溶液の色は無色、10%水溶液の密度は1.0594g/mLです。水への溶解度は、40g/100mL (20 °C) とされます。
塩素酸の冷たい水溶液はおよそ30%まで安定であり、そこから慎重に減圧することで40%まで濃縮できます。
塩素酸の種類
塩素酸は、主に関連物質である安定な塩素酸塩の状態で販売されています。塩素酸ナトリウムや塩素酸カリウムなどが一般的です。
遊離酸の製品は存在しません。また、名前が類似している物質に次亜塩素酸水や亜塩素酸水などがありますが、これらも塩素酸の水溶液とは別物であるため注意が必要です。
塩素酸のその他情報
1. 塩素酸の合成
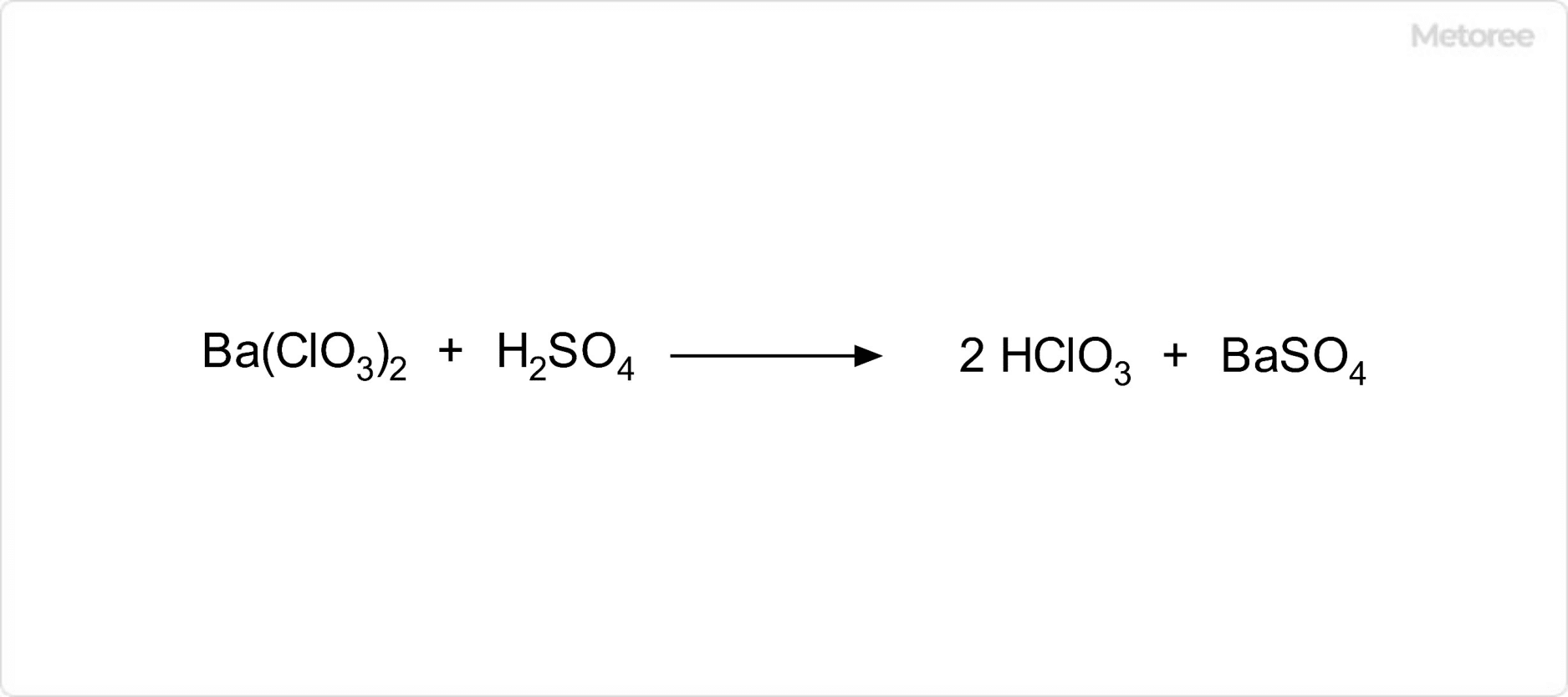
図2. 塩素酸の合成
塩素酸は希硫酸と塩素酸バリウム水溶液を混合することで合成が可能です。この反応では、不溶性の硫酸バリウムが析出して塩素酸水溶液を生じます。析出した硫酸バリウムの沈殿を取り除くことで塩素酸水溶液を得ることが可能です。
2. 塩素酸の化学反応
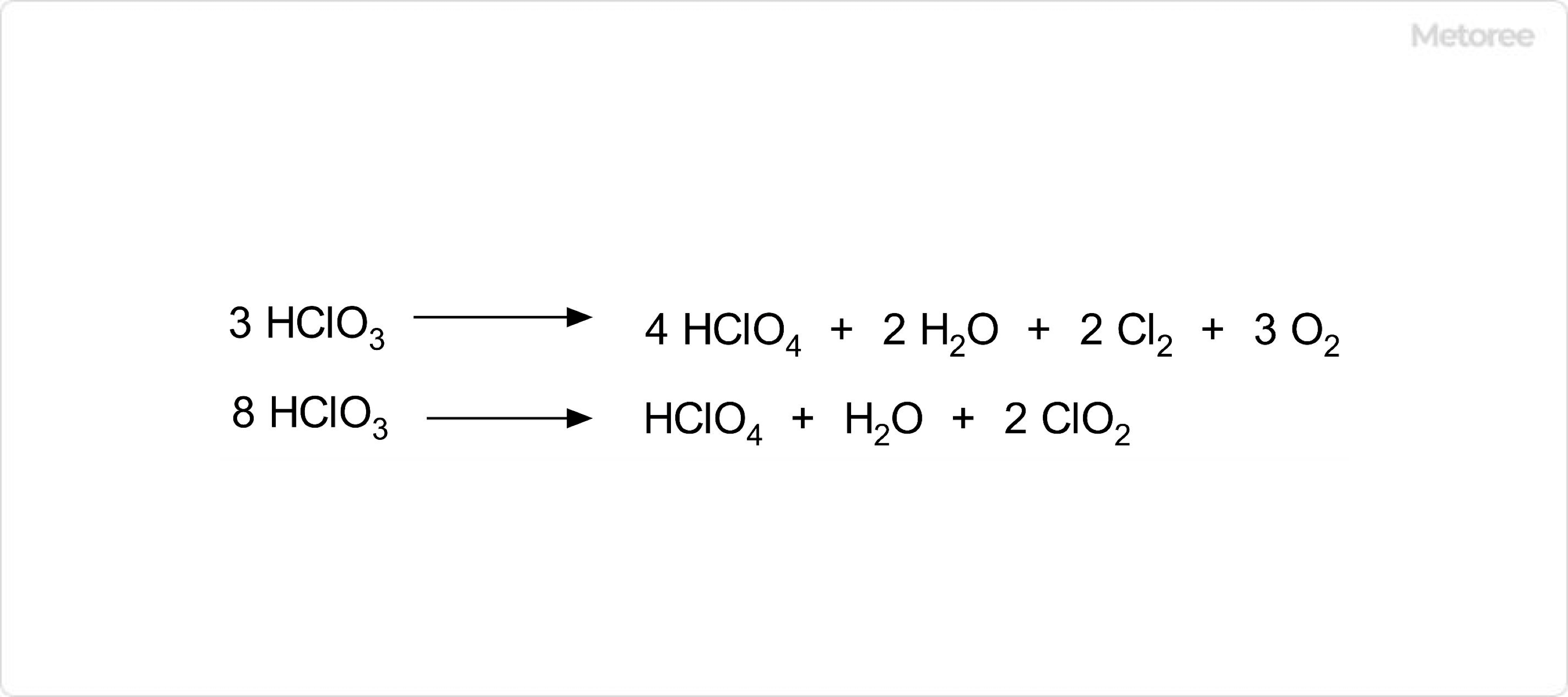
図3. 塩素酸の分解反応
塩素酸は、減圧下で濃縮することにより約40%の溶液を得ることができますが、40%以上に濃縮すると分解して各種塩素化合物と酸素を発生します。このとき生じる塩素化合物には、過塩素酸や、二酸化塩素、塩素など様々なものがあります。
また、塩素酸水溶液は接触により有機材料が発火するとされています。有機物、金属粉末、アンモニアと爆発性混合物を作るため、これらの物質との混合は避けるべきです。
特にセルロース、硫化銅、酸化性物質は混触危険物質に指定されています。危険有害な分解生成物は、腐食性を有する塩素、酸化作用を有する酸素とされています。
3. 塩素酸の関連物質
塩素酸の関連物質には、下記の各種の塩素酸塩が挙げられます。いずれも不安定で取り扱いに注意を要する物質です。
- 塩素酸ナトリウム
- 塩素酸カリウム
- 塩素酸アンモニウム
- 塩素酸カルシウム
- 塩素酸バリウム
- 塩素酸亜鉛
- 塩素酸銀(I)
4. 塩素酸水溶液の有害性
塩素酸水溶液は、GHS分類で下記のように指定されている物質です。取り扱いの際には、適切な局所排気装置や、個人用保護具 (保護衣・保護メガネなど) を使用することが必要です
- 酸化性液体: 区分1~2
- 金属腐食性物質: 区分1
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/cas-7790-93-4.html