塩化クロムとは
塩化クロムとは、クロムの塩化物です。
塩化クロムには酸化数の異なる化合物が存在し、塩化クロム (II) 、塩化クロム (III) 、塩化クロム (IV) です。
塩化クロム (II) は、白熱した金属クロムに塩化水素を加えて得られます。塩化クロム (III) は塩素の気流下で、金属クロムを強く熱すると生成します。塩化クロム (IV) は、塩化クロム (III) と塩素を600~700°Cに熱すると得られますが、不安定で単離は容易ではありません。
塩化クロムの使用用途
塩化クロムは、有機反応の触媒、めっき、顔料、医薬品、媒染剤などに使われます。塩化クロム (II) は、主にクロムめっき技術で使用可能です。
電気めっきによって、装飾用の金属上にクロムの薄層を堆積させることで、耐腐食性および表面硬度が増大します。織物媒染剤に使用する場合には、染色する布と染色剤との間でリンクとして作用します。また、塩化クロム (II) は、オレフィンや防水剤の生産のための触媒として使用可能です。
クロム (III) は耐糖能因子の一部であり、インスリンが促進する反応の活性化因子です。その効果を利用して、グルコース、タンパク質、脂質の代謝を活性化し、人間や動物のインスリン作用を促進する医薬品に使用されています。
塩化クロムの性質
塩化クロム (II) は無色の針状結晶で、塩化クロム (III) は赤紫色の結晶です。高温で塩化クロム (IV) は、安定な気体として存在します。
HSAB則で塩化クロム (III) はルイス酸です。3価のクロムは配位子の置換反応の活性が低いですが、少量の亜鉛や塩酸などの還元剤を加えると、活性が向上します。
塩化クロム (II) に還元されて、すぐに配位子の交換反応が起き、CrCl3と塩素架橋を介した電子転移が起こり、3価のクロム錯体が得られます。活性化したCr (II) は再生可能です。Cr (III) がすべて置換されるまで反応は進みます。
塩化クロムの構造

図1. 塩化クロムとピリジンの錯体
塩化クロム(II) は二塩化クロム、塩化クロム(III)は三塩化クロム、塩化クロム (IV) は四塩化クロムとも呼ばれます。塩化クロム (II) の化学式はCrCl2、塩化クロム (III) の化学式はCrCl3、塩化クロム(IV)の化学式はCrCl4です。
塩化クロム (II) の分子量は122.90、塩化クロム (III) の分子量は158.36、塩化クロム(IV)の分子量は193.81です。塩化クロム (III) の無水物は紫色の結晶であり、水にはほとんど溶けません。
六水和物のCrCl3・6H2Oは錯体であり、水和異性体である[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2・H2O、[Cr(H2O)4Cl2]Cl・2H2Oが存在します。配位子にピリジンを用いると[CrCl3(C5H5N)3]が生成し、ほとんどのCr(III)錯体は配位数6の八面体構造を取っています。
塩化クロムのその他情報
1. 塩化クロムの合成法
高温で単体を化合すると塩化クロム (III) の無水物が合成できますが、炭素の存在下で三酸化二クロムと塩素を800°Cで反応させても生成します。塩化クロム (III) の水和物は、塩酸とクロムの反応で合成可能です。650°Cで塩化クロム (III) 六水和物は四塩化炭素と反応して、無水物が得られます。塩化チオニルを用いても脱水可能です。
500°Cで水素を用いて塩化クロム (III) を還元すると、塩化クロム (II) が生成します。塩化クロム (II) は、塩化水素と酢酸クロムの反応でも合成可能です。
2. 原料としての塩化クロム
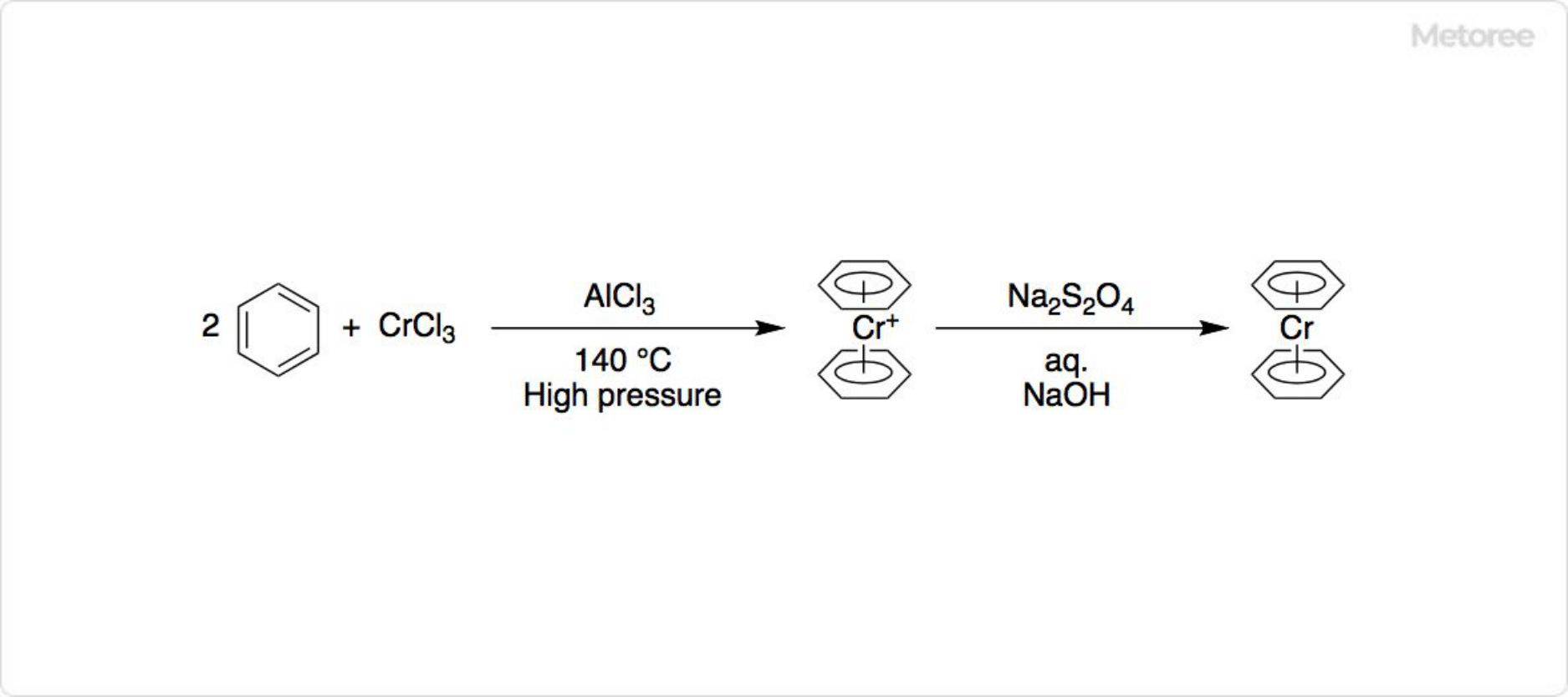
図2. 有機クロム化合物の合成
塩化クロム (III) の無水物は、有機金属化学で重要な原料です。フェロセンに構造が似ているジフェニルクロムなど、さまざまな有機クロム化合物を合成できます。
3. 塩化クロムを用いた反応
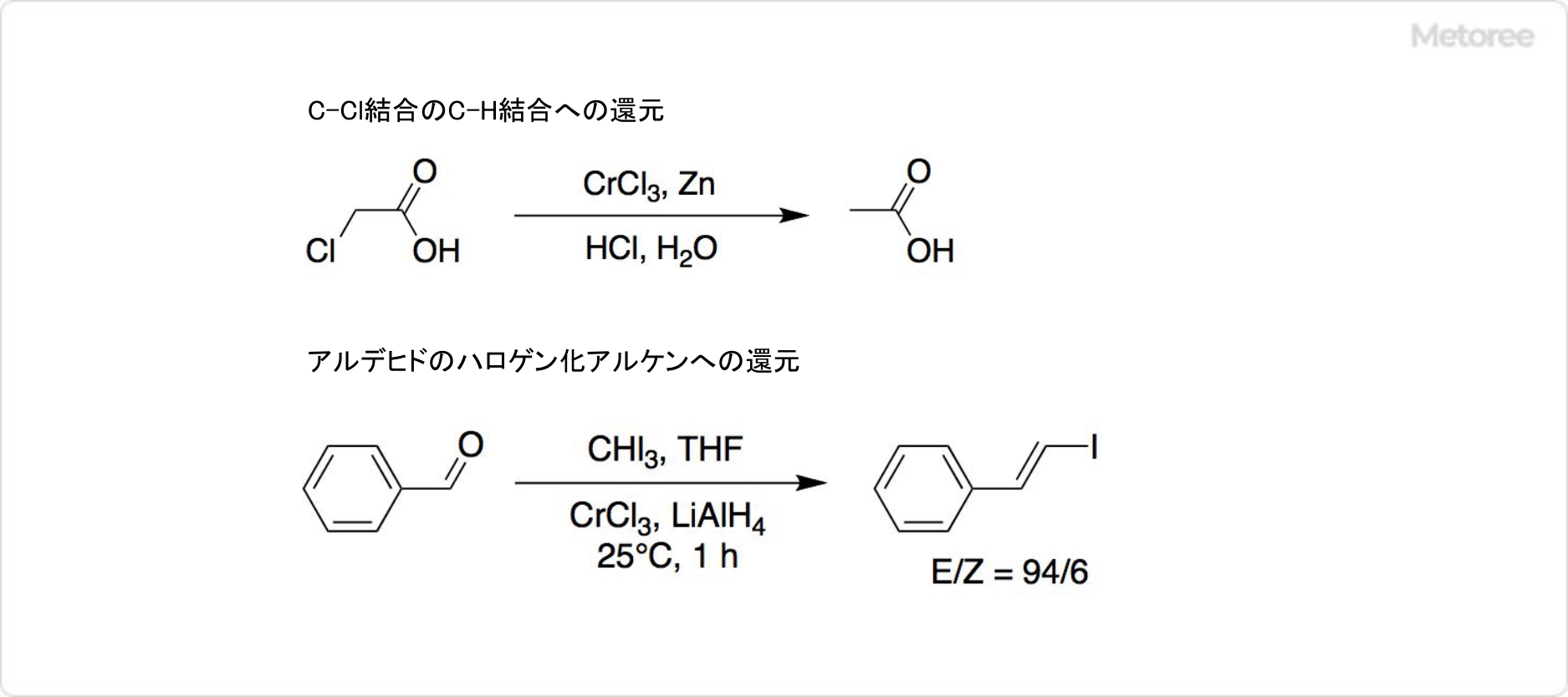
図3. 塩化クロムを用いた反応
一般的に塩化クロム (III) を還元した塩化クロム(II) は、有機還元剤として有機合成に使用可能です。 C-Cl結合をC-H結合に変えるほか、アルデヒドをハロゲン化アルケンに還元します。アルデヒドの還元反応では、塩化クロム (III) と水素化アルミニウムリチウムを通常2:1のモル比で使用します。