スルファミン酸とは

スルファミン酸とは、硫酸のヒドロキシ基をアミノ基に置換して得られる構造を有する水溶性の化学物質です。
アミド硫酸とも呼ばれます。常温では白色の固体で、加熱すると205°Cで分解します。エタノールに溶けにくいです。固体は吸湿性がなく、純品を得やすいです。スルファミン酸は尿素と発煙硫酸を用いて合成できます。
スルファミン酸は亜硝酸と反応すると、窒素ガスを生じます。還元剤として働くため、硝酸との反応では亜酸化窒素を生成可能です。
スルファミン酸の使用用途
スルファミン酸は、人工甘味料であるチクロ (英: Cyclamate) の原料です。別の人工甘味料であるアセスルファムカリウムも、スルファミン酸から合成されます。
スルファミン酸と2-エチルヘキサノールの反応では、硫酸2-エチルヘキシルを合成可能です。硫酸2-エチルヘキシルは、綿のシルケット加工で湿潤剤として使用されます。また、酸塩基滴定では標準物質として用いられます。具体的には、水酸化ナトリウム水溶液の濃度を正確に求めるため、標定に利用可能です。
さらにスルファミン酸は、金属やセラミックの洗浄剤や錆び落としに使用されます。塩酸の代わりにスルファミン酸が主成分のトイレクリーナーもあり、塩酸特有の臭いがしません。
スルファミン酸の性質
スルファミン酸は水に溶けると強い酸性を示します。酸解離定数はKa = 1.01×10−1です。スルファミン酸水溶液はほぼ無臭で、刺激性はありません。容易に金属塩を溶かしますが、金属を腐食しません。
スルファミン酸を水中で加熱すると、アンモニアが放出され、硫酸になります。冷水中で徐々に、80°C以上ですぐに加水分解し、硫酸水素アンモニウムに変わります。
スルファミン酸の構造
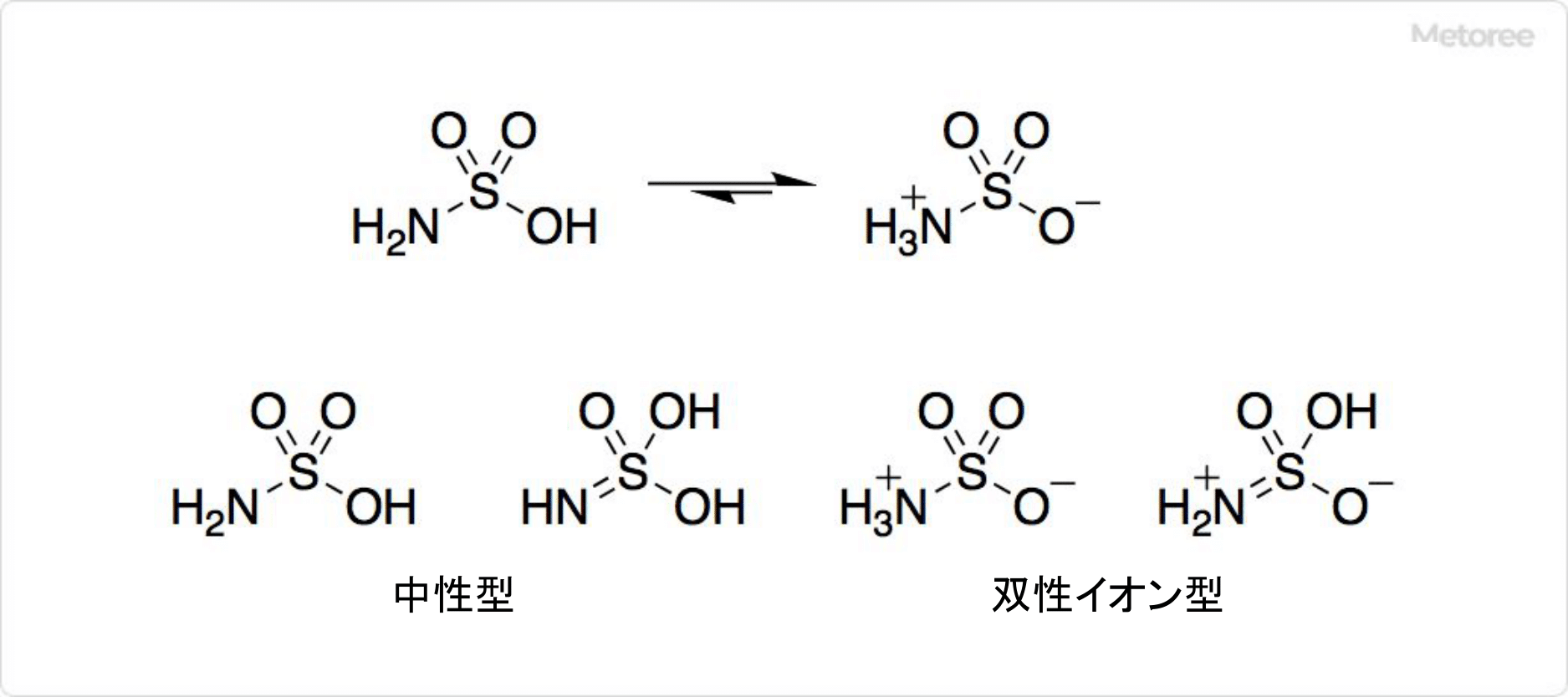
図2. スルファミン酸の構造
スルファミン酸の化学式はH3NSO3で、モル質量は97.10g/mol、密度は2.15g/cm3です。液体アンモニア中で、水素イオンを2段階放出し、ジアニオンを生じます。
スルファミン酸の構造は、4種の異性体の中で、中性型ではなく、互変異性体である双性イオン型の1つを取っています。中性子回折法の結果により、結晶中では水素原子3つがすべて窒素から1.03Åの距離に位置しているためです。硫黄原子と酸素原子の結合距離は1.44Å、硫黄原子と窒素原子の結合距離は1.77Åです。硫黄-窒素結合は、長い単結合性と短い二重結合性があります。
スルファミン酸のその他情報
1. スルファミン酸の反応
スルファミン酸やスルファミン酸塩を、過剰な次亜塩素酸イオンと反応させると、N-クロロスルファミン酸イオンやN,N-ジクロロスルファミン酸イオンが可逆的に生成します。そのため、スルファミン酸は、ピニック酸化 (英: Pinnick oxidation) などの亜塩素酸塩によるアルデヒドの酸化で、次亜塩素酸塩の捕捉剤 (英: scavenger) として使用されます。
スルファミン酸とアルコールを加熱すると、対応する硫酸エステルを生成可能です。クロロスルホン酸や発煙硫酸などと比べると高価ですが、非常に温和な反応であり、芳香環のスルホン化も起こりません。尿素が触媒として働き、生成物はアンモニウム塩になります。100°C以下で触媒が存在しない場合には、スルファミン酸とエタノールは反応しません。
2. スルファミン酸を用いたチクロの合成
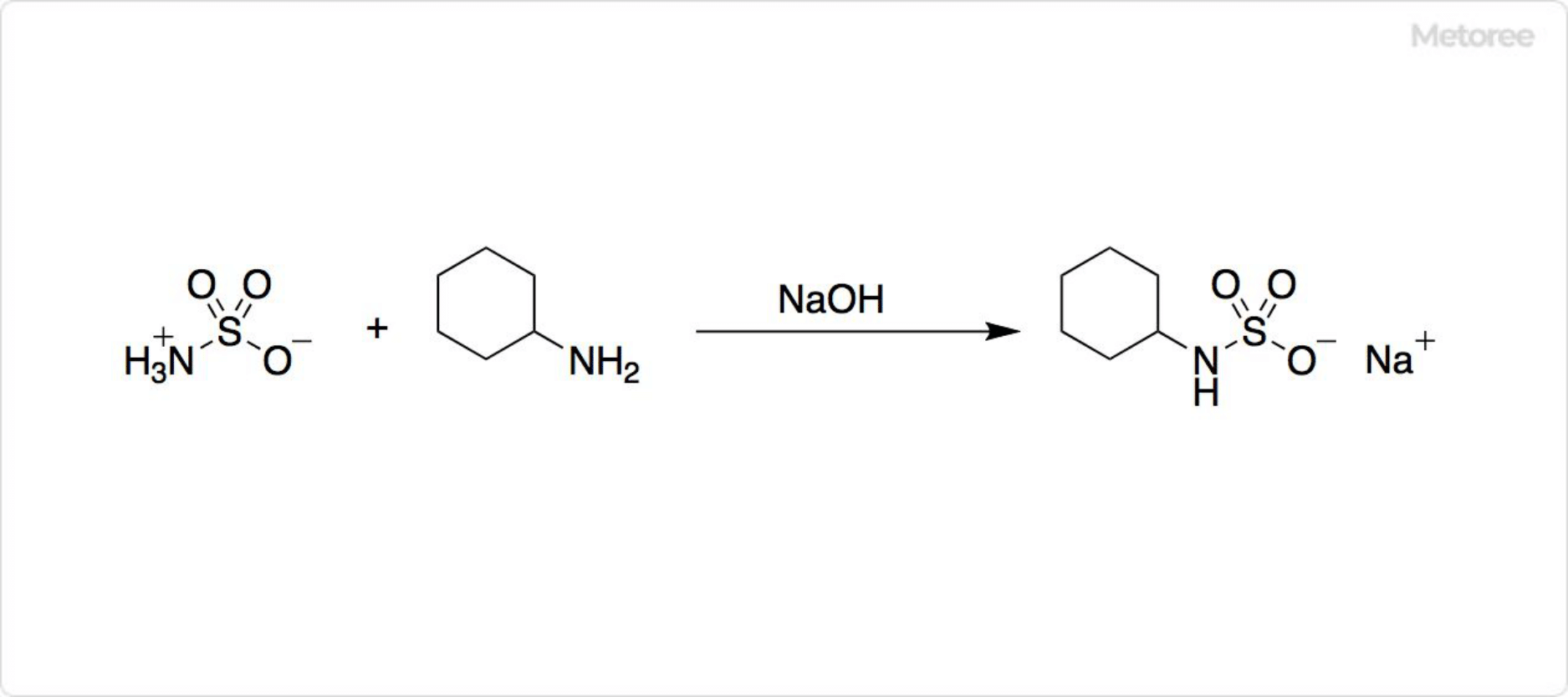
図3. スルファミン酸からチクロの合成
水酸化ナトリウムを用いて、スルファミン酸とシクロヘキシルアミンが反応すると、人工甘味料であるチクロを合成可能です。チクロは少しベージュ色を帯びている板状結晶であり、サイクラミン酸ナトリウムやN-シクロヘキシルスルファミン酸ナトリウムとも呼ばれます。チクロの甘さは、砂糖の30〜50倍程度です。高濃度の場合には、わずかに後味が苦くなります。