リン化亜鉛とは
リン化亜鉛 (英:Zinc phosphide) とは、組成式Zn3P2で表される、リンと亜鉛から構成される無機化合物です。
別名では、ニリン化三亜鉛 (英: Trizinc diphosphide)とも表記されます。CAS登録番号は、1314-84-7です。
リン化亜鉛の使用用途
リン化亜鉛の主な使用用途は、殺鼠剤や殺虫剤です。一般的には、家ネズミや野ネズミの駆除に用いられています。ニュージーランドにおいては、フクロギツネの駆除にもペースト剤が利用されている他、ポプラのヤナギシリジロゾウムシに対する殺虫剤としても使用されている物質です。
リン化亜鉛の殺鼠剤としての作用のメカニズムは、リン化亜鉛がネズミの胃酸と反応して、毒性の強いリン化水素ガス (ホスフィン) を生じることによります。この時生じるリン化水素ガスは、中枢神経を侵して呼吸困難を引き起こし、ネズミを死滅させる効果があります。それ以外の産業用用途では、太陽光発電セルに用いられる場合があります。
リン化亜鉛の性質

図1. リン化亜鉛の基本情報
リン化亜鉛は、分子量258.1、融点420℃、沸点1,100℃であり、常温では暗灰色の固体または粉末です。
密度は4.6g/mLであり、水に対して溶解せずに徐々に分解する性質があります。それ以外では、二硫化炭素及びベンゼンに微溶であり、アルコールには殆ど溶けません。不燃性の物質です。
リン化亜鉛の種類
リン化亜鉛は主に研究開発用試薬製品や、産業用無機化合物材料として一般に販売されています。研究開発用試薬製品では、10g、25g、1kgなどの容量の種類があり、実験室で取り扱いやすい容量が中心での提供です。通常、室温で取り扱い可能な試薬製品として扱われます。
産業用無機化合物材料としては、殺鼠剤などの原料の他、太陽光発電セル材料などを想定して販売されています。
リン化亜鉛のその他情報
1. リン化亜鉛の合成
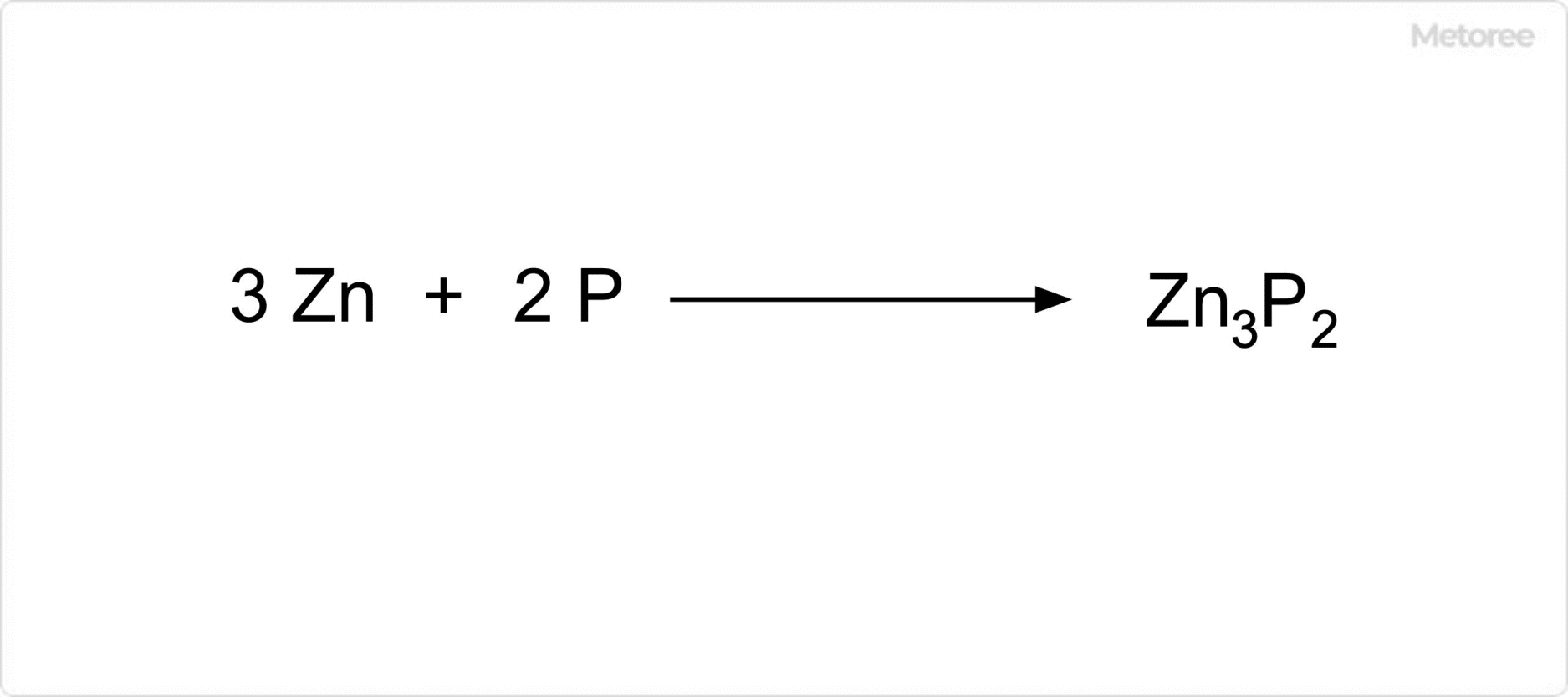
図2. リン化亜鉛の合成
リン化亜鉛は、リンと亜鉛を反応させることで合成することが可能です。その他の合成方法としては、トリ-n-オクチルホスフィンとジメチル亜鉛との反応があります。
2. リン化亜鉛の化学反応
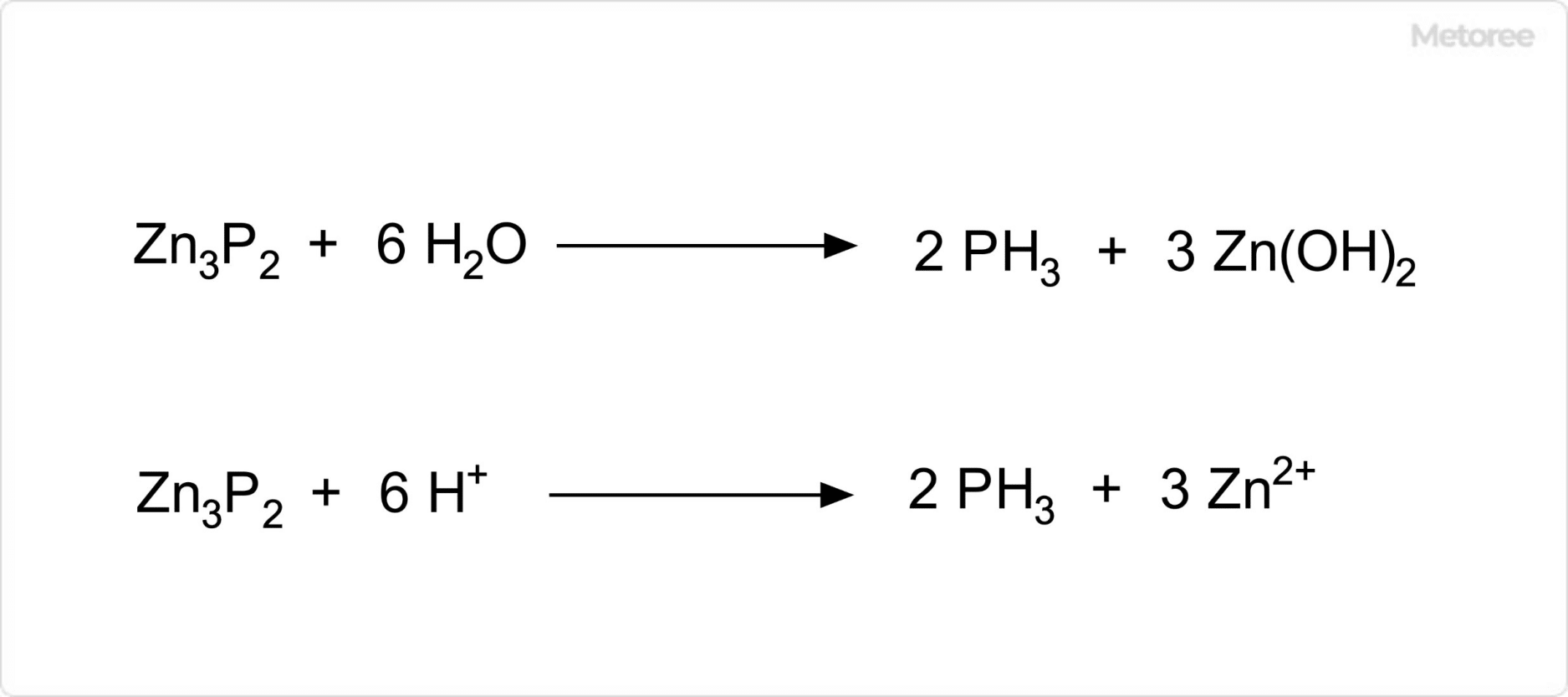
図3. リン化亜鉛の化学反応
リン化亜鉛は、水と反応してリン化水素ガス (ホスフィン) と水酸化亜鉛に分解します。また、前述の通り、酸と反応して亜鉛イオンとリン化水素ガスを生じます。このリン化水素ガスは、無色の悪臭がするガスで、強い毒性を有する物質です。そのため、リン化亜鉛の取り扱いや保存には、注意が必要です。
リン化亜鉛は、加熱によっても分解し、リン酸化物や亜鉛酸化物などの有毒で引火性のヒューム及びホスフィンを生じる物質です。また、強酸化剤とも激しく反応し、火災の危険を生じるとされています。強酸化剤、酸、水は、リン化亜鉛の取り扱いにおいて混触危険物質に指定されています。
3. リン化亜鉛の有害性と法規制情報
リン化亜鉛は前述の通り、分解によって有害なリン化水素ガスを生じる物質です。人体への有害性として、以下が挙げられます。
- 飲み込むと生命に危険
- 強い眼刺激
- 中枢神経系、呼吸器、肝臓、腎臓、血液系の障害
- 長期にわたる、又は反復ばく露による中枢神経系、腎臓、血液系の障害
- 長期にわたる、又は反復ばく露による肝臓の障害のおそれ
また、 リン化水素ガスはリン化亜鉛が水に触れると発生しますが、可燃性の気体です。これらの有害性により、毒物及び劇物取締法では劇物に指定されています。
消防法では、「 第3類自然発火性物質及び禁水性物質、金属のリン化物」「貯蔵等の届出を要する物質」に指定されている物質です。その他、道路法、航空法、船舶安全法、港則法、水道法、下水道法、大気汚染防止法、水質汚濁防止法などでも制限を受けています。