オゾンとは
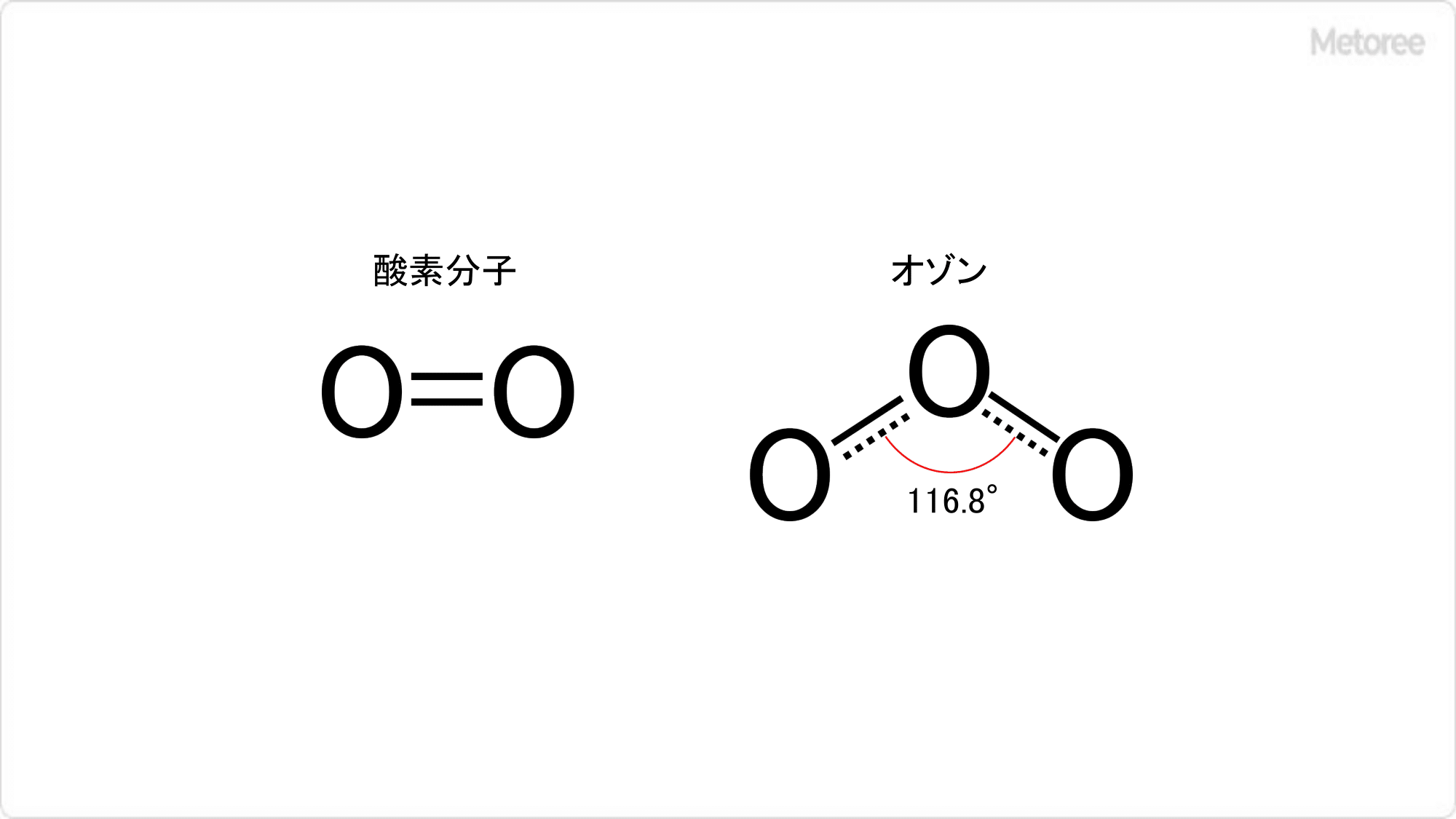
オゾン (O3) とは、3個の酸素原子からなる酸素 (O2) の同素体です。
ギリシャ語の「ozein (臭う) 」に由来する名前の通り、オゾンは青臭い特有の刺激臭をもった気体です。紫外線や雷の放電などの強い刺激が酸素分子に与えられることにより作られるので、自然環境中にも存在して、大気の自浄作用 (殺菌・脱臭など) を担っている言われています。
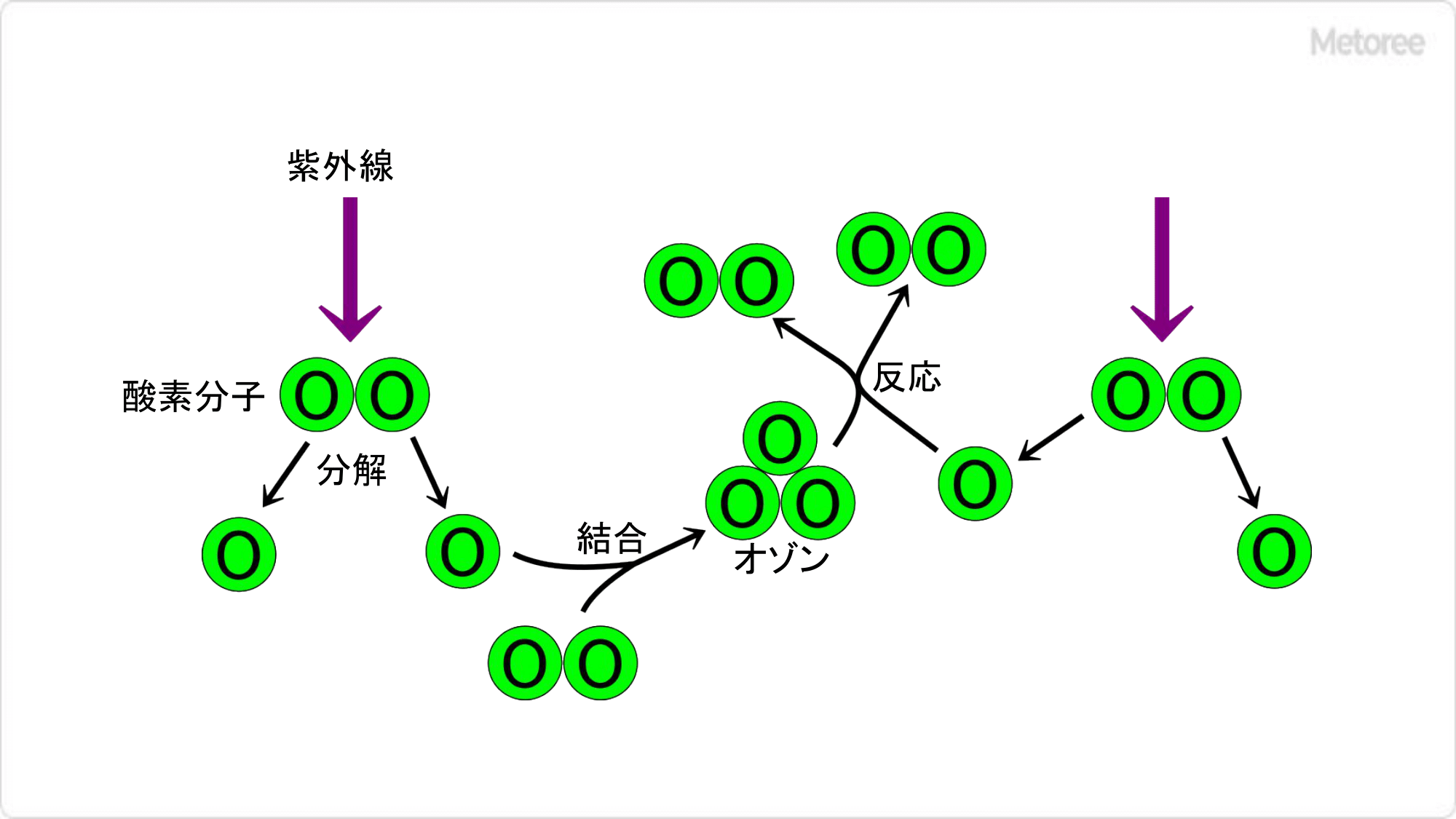 図2. 成層圏大気中でのオゾンの生成と消滅
図2. 成層圏大気中でのオゾンの生成と消滅
地表付近の清浄な空気中でのオゾンは 0.1ppm 以下の低濃度です。一方、成層圏 (約 10~50km 上空) にはオゾン濃度が 2~8ppm と高いオゾン層があり、太陽光中に含まれる有害な紫外線のほとんどを吸収して、地上の生態系を保護しています。もし、このオゾン層がなくなれば、太陽からの強力な紫外線が直接降り注ぐ陸上では生命が存在できません。
オゾンの使用用途
オゾンは、上・下水の処理やし尿処理、医療現場、食品製造や貯蔵現場、畜産や水産現場、飲食店やホテル、スーパーマーケット、保育園、一般家庭など、多種多様な場面での殺菌や消臭に利用されています。
空気中に多量に存在する酸素を原料とするため、装置と空気さえあればどのような場所でもオゾンを製造可能です。また、巨大な工業用オゾン発生装置から電池で作動するポータブルな装置まで、さまざまなオゾン発生装置が市販されています。
そのため、オゾンは誰でも手軽に自家製造できると言っても過言ではありません。
オゾンの性質
常温常圧下では、オゾンは気体として存在します。オゾンの沸点は -112℃で、比重は空気の 1.66倍 (0℃・1気圧) と重く、水への溶解度は 0.57g/L (20℃ ・1気圧) で、酸素の約 10倍です。
1. 酸化力
オゾンは非常に不安定な気体であるため、反応相手に対して酸素原子 (O) を与える強い力 (酸化力) を発揮し、反応対象がない場合でも、常温で徐々に分解して酸素に変化します。天然に存在する酸化剤の中では、オゾンの酸化力 (酸化還元電位) は、フッ素に次いで高く、過酸化水素・次亜塩素酸・塩素などを上回っています。
従って、ほとんどの有機物や金属をオゾンによって酸化することが可能です。
2. 消臭・殺菌効果
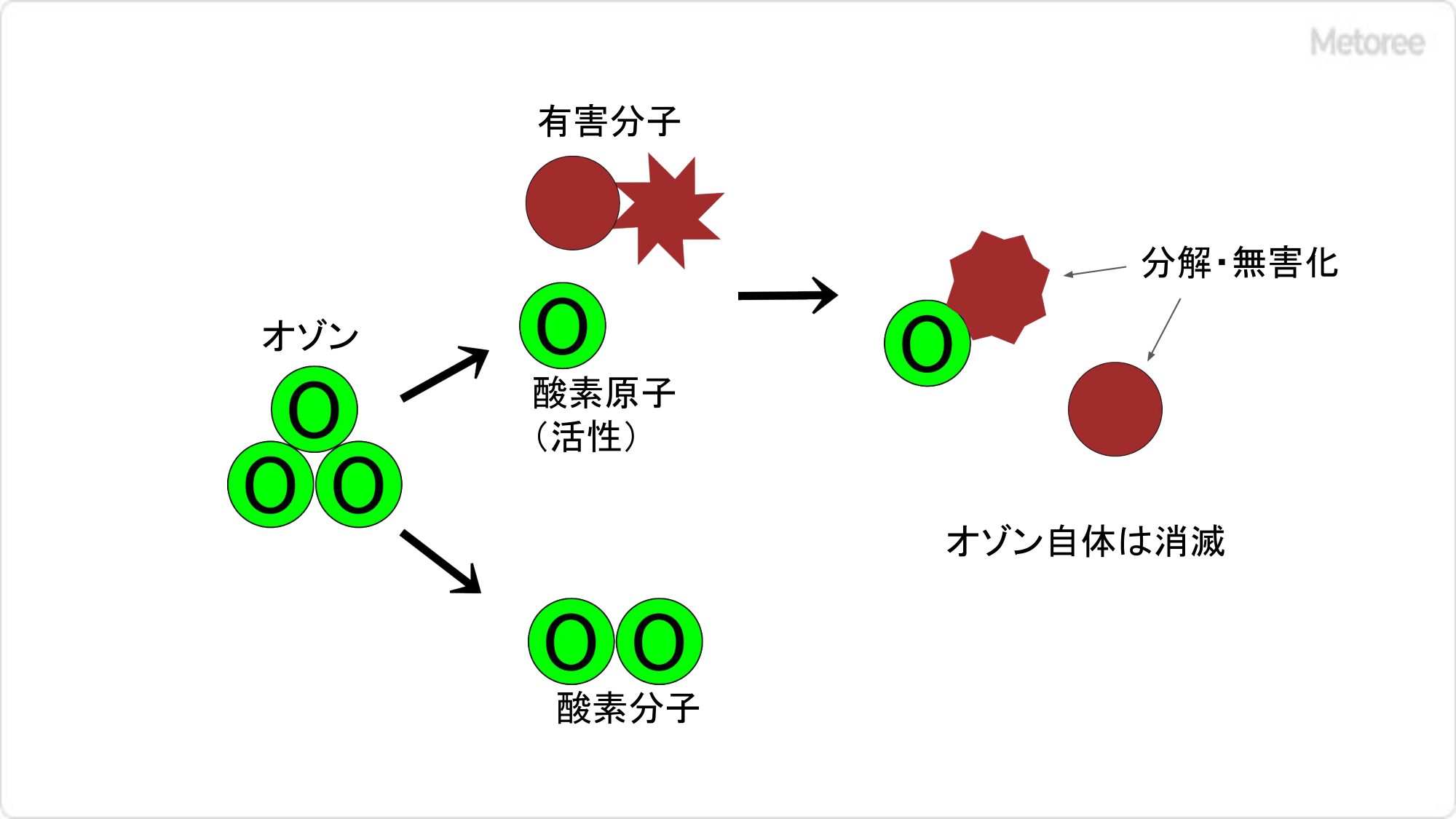
図3. オゾンによる有害分子の無害化
オゾンはその強力な酸化作用により、相手が有機物か無機物かを問わず、酸化されうる化学物質と反応して相手を分解することで、消臭や無毒化を行います。臭気成分の多くは酸化されやすい化学組成をもっているため、オゾンによる脱臭が大変効果的です。
また、オゾンは細菌の細胞膜を破壊して死滅させたり、ウイルスを不活化させることができます。水に溶けた状態での殺菌力に関する研究報告によると、オゾンは塩素の約 1/10 程度の低濃度で同等の効果を発揮します。
オゾンのその他情報
1. オゾンの利点
- 耐菌性を作らない。
- 気体のため空気中に拡散して、臭気や VOC などの有害な気体を分解することができる。
- 繊維中に浸透して色素を分解することができるので、漂白効果がある。
- オゾンが大量に大気中に放出されたとしても、酸素に変化するか反応相手の一部と結びついた酸化物となり、毒性のある副次物を残さない。
- 空気中の酸素を原料にできるので、製造装置さえあれば、どのような場所でも任意の量を造ることができる。
- 濃度の制御が容易で、他の酸化漂白剤に比べて安全。
- 相手が固体の場合は、反応が表面に限定され内部を変質させることがない。
- ホルマリンのように臭気を残すことがない。
2. オゾンの毒性
人が高濃度のオゾンに暴露された場合、オゾンは水に吸収されにくいため、気管支や肺の深部にまで到達することがあります。強い酸化力を持つオゾンが鼻や喉の粘膜に刺激を与えて、ぜん息の発作や気管支炎等の呼吸器系疾患を引き起こしたり、眼の粘膜などに障害を与えたりする可能性も高いです。
オゾンは、光化学オキシダント (Ox) の主な成分です。葉の気孔から空気を取り込む植物に対しては、その細胞組織を破壊して成長阻害や老化などの影響を与えます。また、ゴムやプラスチックなどの非生物に対しても、劣化促進作用のあることが知られています。