トリクロロエタンとは

トリクロロエタンとは、分子式がC2H3Cl3で表される有機ハロゲン化合物です。
塩素原子の位置によって、1,1,1-トリクロロエタンと1,1,2-トリクロロエタンの2種類に分類されます。別名、1,1,1-トリクロロエタンは、クロロテンやメチルクロロホルムとも呼ばれ、常温で無色の液体です。
ヒトの皮膚や目に対して刺激性を持ち、労働安全衛生法で「名称等を表示・通知すべき有害物」に指定されている他、PRTR法で「第一種指定化学物質」に指定されています。
トリクロロエタンの使用用途
1,1,1-トリクロロエタンは、様々な有機化合物を溶かせるため、電子部品の洗浄や塗料の溶剤などの用途で、有機溶媒として広く利用されていました。しかし、モントリオール議定書でオゾン層破壊物質として指定されて以降、全世界で1,1,1-トリクロロエタンの使用がほとんど中止されています。
トリクロロエタンの性質
1,1,1-トリクロロエタンの融点は−30°C、沸点は74°Cです。揮発性があり、洗浄能力が大きいです。
一般的に1,1,1-トリクロロエタンは、非極性溶媒に分類されています。しかし、電気陰性度が大きい3個の塩素原子が、分子の片側に偏って存在するため、極性をわずかに有します。
トリクロロエタンの構造
1,1,1-トリクロロエタンと1,1,2-トリクロロエタンは構造異性体の関係にあり、いずれもエタンの炭素原子に結合している4つの水素原子のうち、3つを塩素原子で置換した化合物です。
1,1,1-トリクロロエタンの示性式はCH3CCl3で、分子量は133.40、密度は1.34g/cm3です。
トリクロロエタンのその他情報
1. 1,1,1-トリクロロエタンの合成法
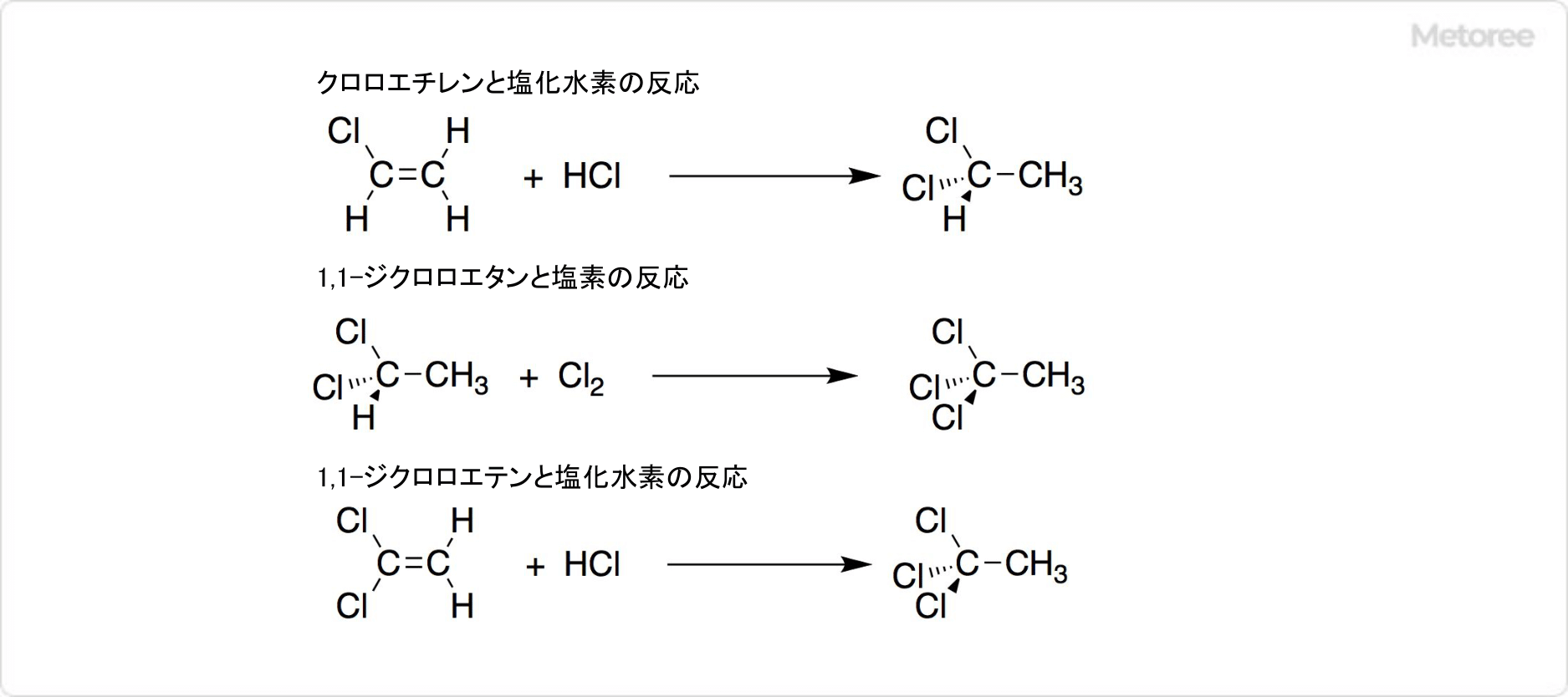
図2. 1,1,1-トリクロロエタンの合成
工業的に1,1,1-トリクロロエタンは、 原料であるクロロエチレンから、2段階で合成可能です。まず、塩化アルミニウム、塩化鉄 (III) 、塩化亜鉛などを触媒に用いて、20〜50°Cでクロロエチレンと塩化水素の反応によって、1,1-ジクロロエタンが生じます。続いて紫外線の照射下で、1,1-ジクロロエタンと塩素が反応すると、1,1,1-トリクロロエタンを得ることが可能です。
収率は80〜90%程度で、発生した塩化水素は再利用できます。構造異性体の1,1,2-トリクロロエタンが、主な副生成物として生じますが、蒸留で分離可能です。
また、触媒に塩化鉄 (III) を使用して、1,1-ジクロロエテン (塩化ビニリデン) と塩化水素が反応すると、少量の1,1,1-トリクロロエタンが得られます。
2. 大気中の1,1,1-トリクロロエタン
モントリオール議定書によって、オゾン層を破壊する原因となる化合物の1つとして、1,1,1-トリクロロエタンが指定され、1996年から使用を禁止されました。その影響で大気中の1,1,1-トリクロロエタンの濃度は、寿命が5年と比較的短いため、急速に減少しています。
3. 1,1,2-トリクロロエタンの特徴
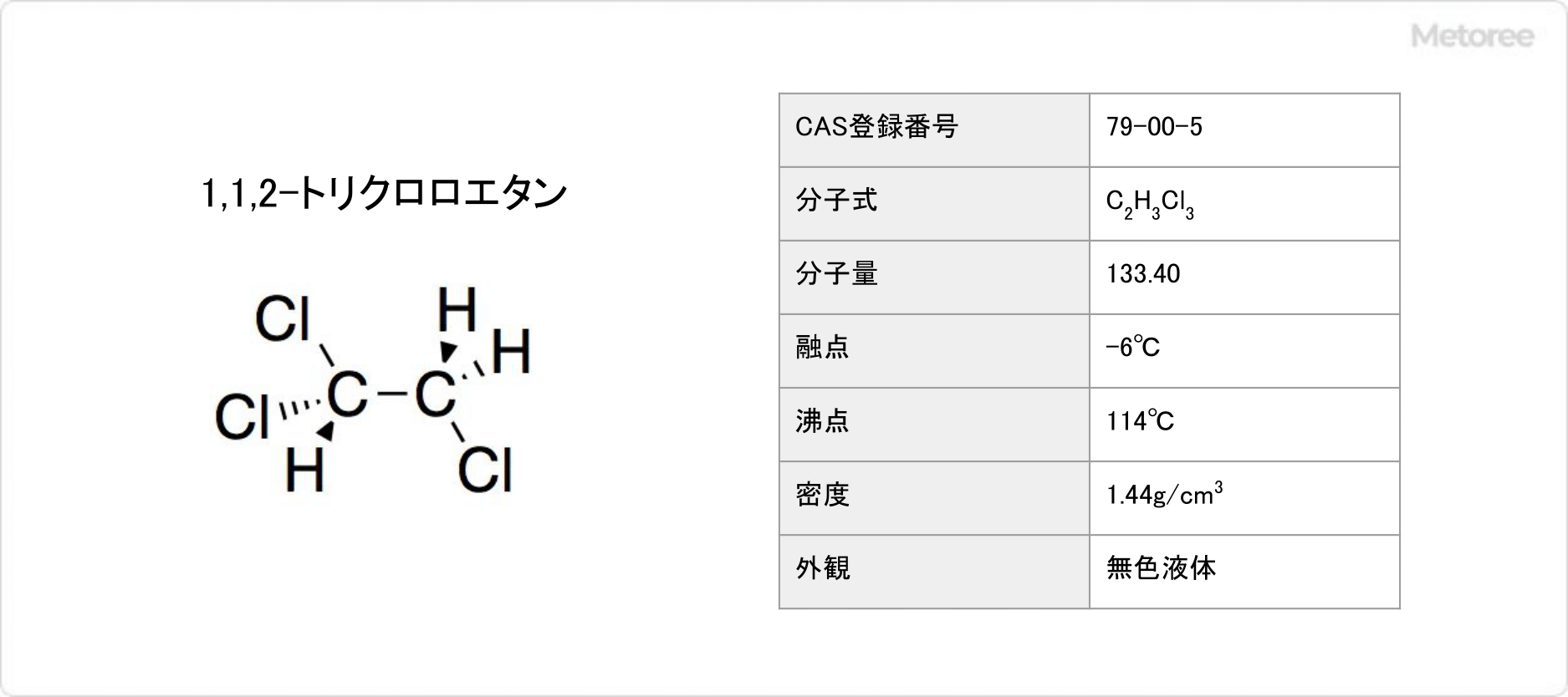
図3. 1,1,2-トリクロロエタンの基本情報
1,1,2-トリクロロエタンは、三塩化ビニルとも呼ばれます。融点は−6°C、沸点は114°Cであり、分子量は133.40、密度は1.44g/cm3です。常温で無色の液体で、甘い香りを有し、示性式はC2H3Cl3です。
中枢神経抑制作用を持つため、吸引すると頭痛や吐き気などの症状を発症します。労働安全衛生法により危険有害物に指定されている他、PRTR法で「第一種指定化学物質」、労働基準法で「疾病気化学物質」に指定されています。
1,1,2-トリクロロエタンは、1,1,1-トリクロロエタンとは異なり、オゾン層破壊物質に指定されていません。そのため現在でも、有機溶媒として使用されており、1,1-ジクロロエタンの合成中間体としても知られています。
参考文献
https://www.gls.co.jp/sds/1021-21133_jpn.pdf
https://anzeninfo.mhlw.go.jp/anzen/gmsds/79-00-5.html