クロロ酢酸とは
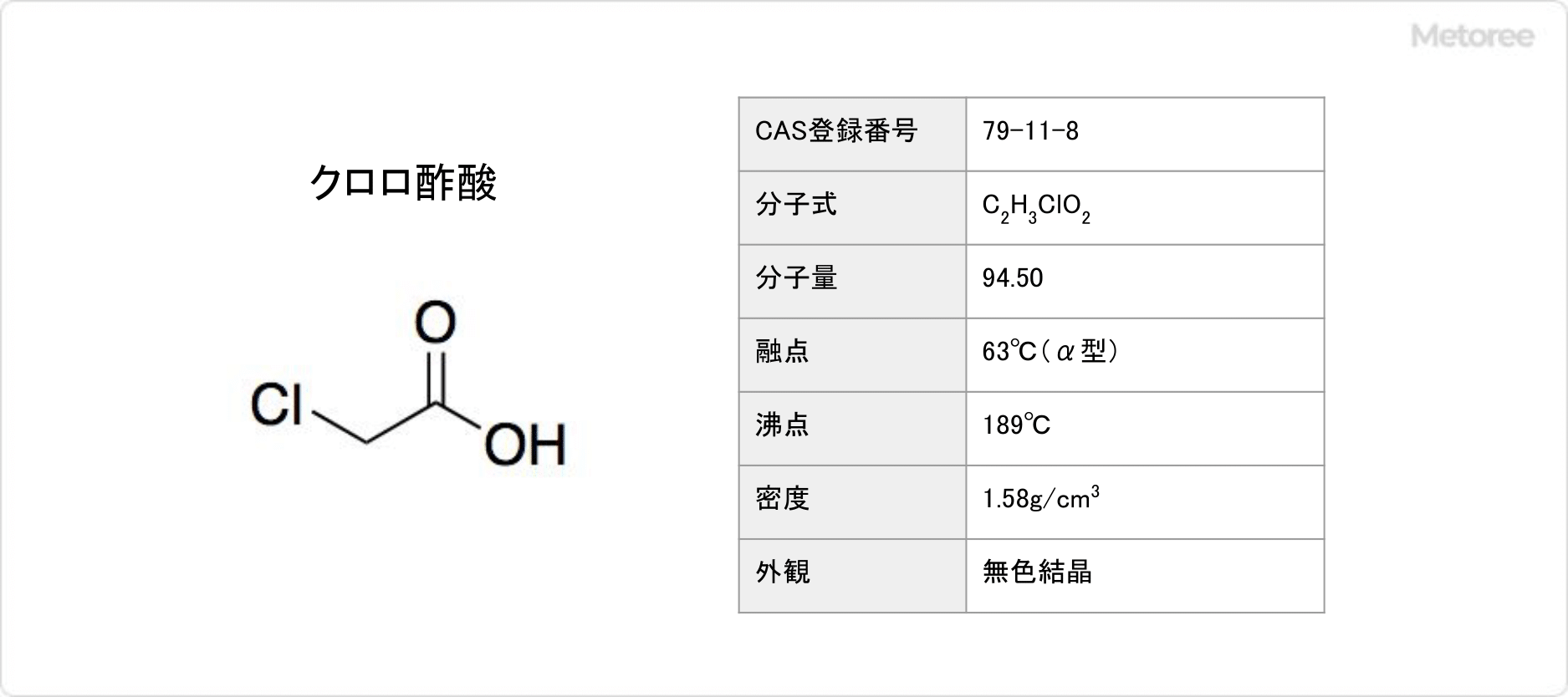
クロロ酢酸 (英: Chloroacetic Acid) とは、化学式がC2H3ClO2で表される有機化合物です。
置換された水素原子の数を強調する際には、モノクロロ酢酸 (英: Monochloroacetic acid) と呼ばれます。
労働安全衛生法では、名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物に該当します。労働基準法には該当しません。化学物質管理促進法 (PRTR法) では第1種指定化学物質に、毒物及び劇物取締法では劇物に、消防法では貯蔵等の届出を要する物質 (200kg以上貯蔵の場合) に該当します。
クロロ酢酸の使用用途
クロロ酢酸は除草剤や界面活性剤に使用されています。強い酸性を持つため、いぼを取り除く治療薬として使用されています。いぼに塗ると組織を腐食・壊死させて取り除けますが、皮膚や粘膜に付着すると水ぶくれや傷になるため、取扱いには注意が必要です。
水道水では消毒剤である塩素と水道水中の有機物が反応し、消毒副生成物の一つとしてクロロ酢酸が生じます。アミノ酸やカルボキシメチルセルロースの合成にも、クロロ酢酸は使用されています。
クロロ酢酸の性質
クロロ酢酸には酢酸に似た刺激臭があります。3種類の形があり、融点はα形が63°C、β形が55~56°C、γ形が50°Cです。潮解性のある無色透明固体で、沸点は189°Cです。
水、エタノール、クロロホルム、ベンゼン、エーテルに溶けます。水溶液は酢酸より強い酸で、25°CでpKa = 2.85です。
クロロ酢酸の構造
クロロ酢酸の分子量は94.50で、密度は1.58です。
示性式はCH2ClCOOHと表されます。
クロロ酢酸のその他情報
1. クロロ酢酸の歴史
1843年に初めてフェリックス・ルブラン (英: Félix LeBlanc) によって、太陽光の存在下で酢酸を塩素化して、不純物を含んだクロロ酢酸が調製されました。
1857年にはラインホルト・ホフマン (英: Reinhold Hoffmann) によって、日光の存在下で塩素と氷酢酸を還流して、純粋なクロロ酢酸が得られました。同年シャルル・アドルフ・ヴュルツ (英: Charles Adolphe Wurtz) も、塩化クロロアセチル (ClCH2COCl) の加水分解によって、クロロ酢酸を合成しています。
2. クロロ酢酸の合成法
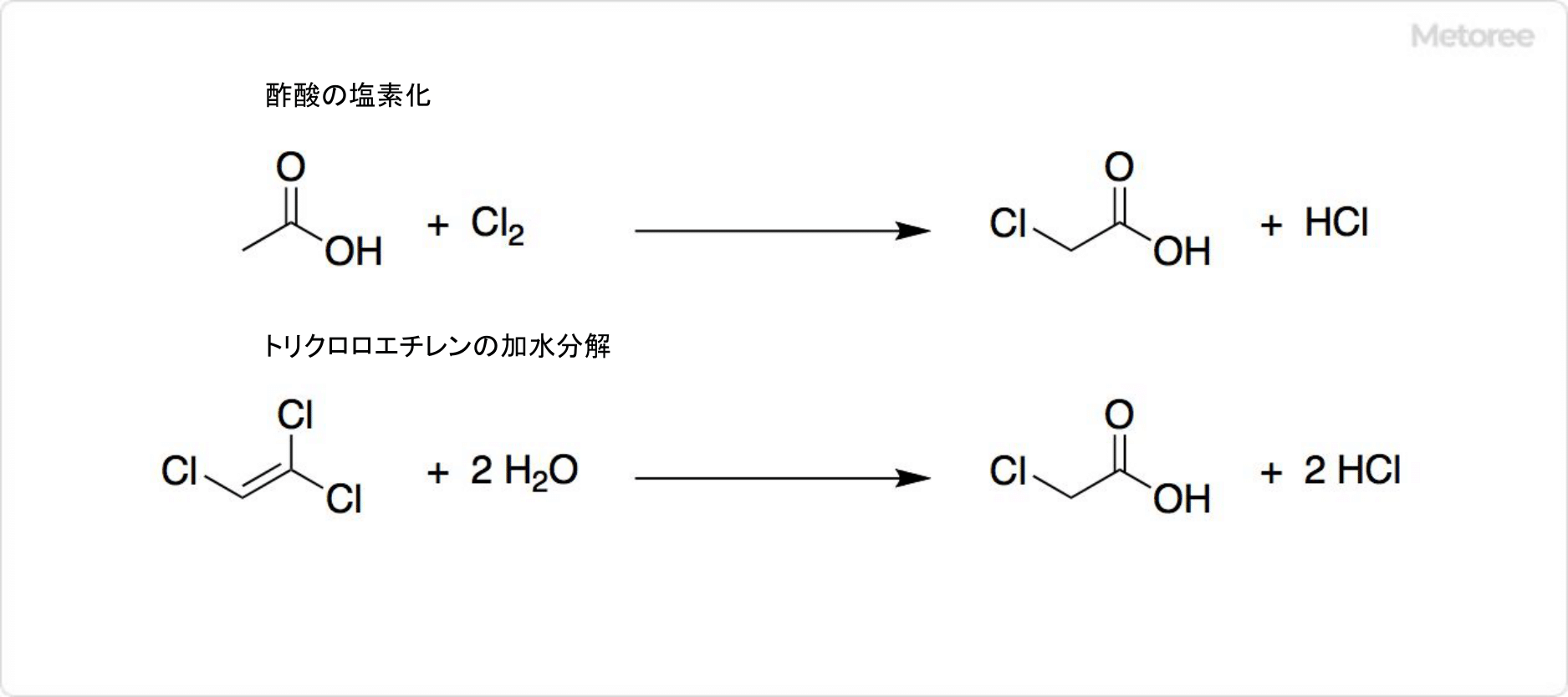
図2. クロロ酢酸の合成
世界中で年間約42万トンのクロロ酢酸が生産されています。触媒として無水酢酸を使用して、酢酸の塩素化によってクロロ酢酸が得られます。
130~140°Cの濃硫酸中で、トリクロロエチレンを加水分解しても、クロロ酢酸を生成可能です。この反応ではハロゲン化よりも高純度のクロロ酢酸が得られますが、大量のHClが放出されます。
3. クロロ酢酸の反応
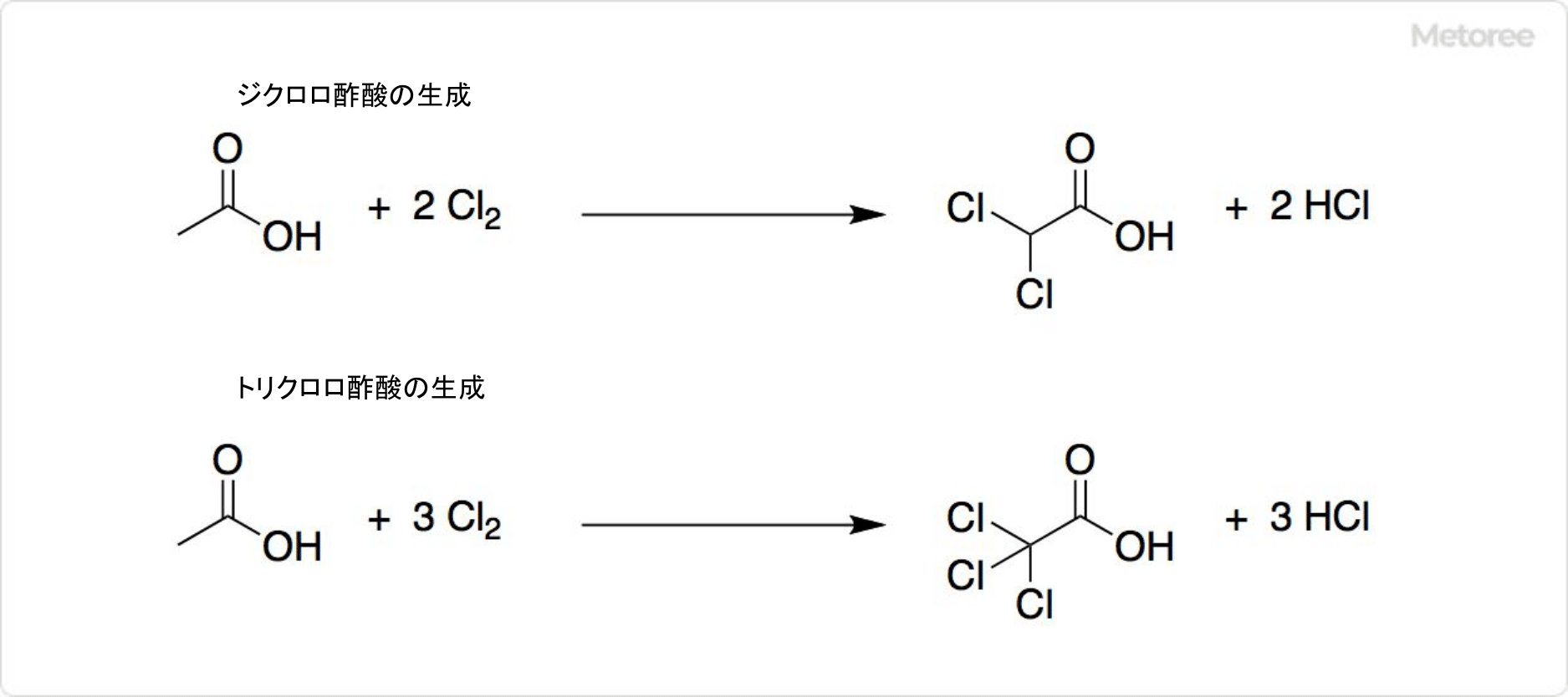
図3. クロロ酢酸の反応
酢酸の塩素化では、クロロ酢酸だけでなく、ジクロロ酢酸とトリクロロ酢酸も生成します。ジクロロ酢酸とトリクロロ酢酸は蒸留での分離が困難な不純物です。
有機化学では、サリチルアルデヒドのO-アルキル化に使用されます。得られたエーテルを脱炭酸すると、ベンゾフランを生成可能です。
4. クロロ酢酸の応用
クロロ酢酸を用いた多くの反応では、C–Cl結合の高い反応性を利用しています。増粘剤であるカルボキシメチルセルロースやカルボキシメチルスターチの合成に、クロロ酢酸は使用されます。
クロロフェノールとのエーテル化によって、フェノキシ系除草剤を製造可能です。例えば、2-メチル-4-クロロフェノキシ酢酸、2,4-ジクロロフェノキシ酢酸、2,4,5-トリクロロフェノキシ酢酸を合成できます。
除草剤のグリホサート (英: Glyphosate) やジメトエート (英: Dimethoate) の前駆体でもあります。クロロ酢酸はアドレナリンの前駆体である塩化クロロアセチルに変換可能です。塩化物を硫化物で置換すると、ポリ塩化ビニル (PVC) の安定剤や化粧品の成分として使用されているチオグリコール酸を合成可能です。